Металлический расплав
Металлический расплав содержит различные примеси (С, Si, Mn, Ni, Cr, O, P, S и др.), которые по форме существования в железе можно разбить на группы:
- Mn, Ni, Cr и др. Размеры их атомов и железа отличаются незначительно (до 10-15%). Такие примеси обладают неограниченной растворимостью в жидком железе и высокой в твердом, образуя с железом твердые растворы типа замещения;
- С, N, H. Радиусы их атомов меньше, чем у железа в 2-4 раза; они образуют твердые растворы типа внедрения. Углерод с железом, а также с другими металлами дает химические соединения - карбиды, азот – нитриды, водород – гидриды.
- Si, P. В жидком железе их растворимость неограничена, а в твердом – значительна. С железом образуют довольно прочные соединения: кремний – силициды, фосфор - фосфиды.
- О, S. Оба элемента обладают малой растворимостью в твердом железе (~0,01 % О, ~0,015 % S). В жидком железе кислород растворяется ограниченно (~0,23 % при 1600 0С), а S - значительно. С железом образуют прочные соединения: кислород – оксиды, сера – сульфиды.
Важнейшие реакции сталеплавильных процессов
Сталь получают из чугуна и лома методом окислительного рафинирования (т. е. очищения). Кислород для окисления содержащихся в них примесей (углерода, кремния, марганца, фосфора и др.) поступает или из атмосферы, или из железной руды и других окислителей, либо при продувке ванны газообразным кислородом. Стадии окислительного рафинирования:
· передача кислорода металлу из окисляющей фазы;
· окислительные реакции;
· удаление из металла продуктов реакции в отдельную фазу.
Окисление углерода
В современных сталеплавильных процессах главным компонентом металлической шихты является твердый или жидкий чугун, содержание углерода в котором всегда значительно выше, чем в готовой стали. В связи с этим, сталеплавильные процессы сопровождаются процессом удаления избыточного углерода из металла. Выделение из ванны пузырей газа, представляющего продукт окисления углерода, сопровождается интенсивным перемешиванием ее, ускорением процессов тепло- и массообмена, дегазации металла и удаления из него неметаллических включений.
Растворенный углерод в железе условно обозначают [С]. Продуктом реакции окисления углерода в расплаве является преимущественно монооксид углерода СО, хотя при низких концентрациях углерода в металле возможно образование незначительных количеств диоксида углерода СО2. Схематически можно представить реакцию окисления углерода в виде
[С] + [О] = {СО}.
Константу равновесия реакции можно определить из следующего выражения
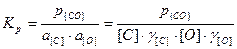 .
.
Для низких концентраций исходных компонентов приближенно считают значения 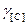 и
и 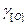 равными единице. Тогда при
равными единице. Тогда при 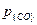 = 1 имеем Кр = 1/[С].[О], а так как 1/Кр = const, то произведение [С].[О] при данной температуре постоянно, его обозначают символом m, т.е. [С].[О] = m. Чем выше содержание углерода в металле, тем ниже содержание кислорода и наоборот. Однако в реальных условиях реакция окисления углерода равновесия не достигает и фактическое содержание кислорода в металле выше, чем равновесное.
= 1 имеем Кр = 1/[С].[О], а так как 1/Кр = const, то произведение [С].[О] при данной температуре постоянно, его обозначают символом m, т.е. [С].[О] = m. Чем выше содержание углерода в металле, тем ниже содержание кислорода и наоборот. Однако в реальных условиях реакция окисления углерода равновесия не достигает и фактическое содержание кислорода в металле выше, чем равновесное.
Выделение оксида углерода возможно, если созданы условия, облегчающие зарождение пузырей СО. Такими условиями могут быть продувка металла кислородом или воздухом и наличие шероховатости на поверхности огнеупорной футеровки, контактирующей с жидким металлом. В этих случаях имеются готовые газообразные полости с развитой поверхностью раздела газ-металл, в которые выделяется монооксид углерода СО, как продукт взаимодействия углерода и кислорода вблизи этой поверхности. Выделяющийся пузырь должен преодолеть давление, представляющее собой сумму давлений – атмосферы печи, столба шлака, столба металла и силы поверхностного натяжения σ расплава, т.е. 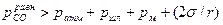 , где r - радиус пузыря монооксида углерода.
, где r - радиус пузыря монооксида углерода.
Снижение внешнего давления (создание разрежения над металлом) в соответствии с принципом Ле-Шателье приводит к смещению равновесия реакции [С] + [О] = {СО} в сторону образования продукта реакции. В равновесных условиях при этом окажется более низкая концентрация кислорода в металле, а углерод становится хорошим раскислителем.
Окисление кремния
Кремний растворяется в железе в любых соотношениях, обладает большим сродством к кислороду и практически полностью окисляется уже в период плавления. Окисление кремния сопровождается выделением большого количества теплоты, поэтому иногда кремний является основным элементом, в результате окисления которого происходит нагрев металла (бессемеровский процесс). Окисление кремния происходит по реакциям
[Si] + 2[О] = (SiO2) + Q; [Si] + 2 (FeO) = (SiO2) + 2[Fe] + Q.
При плавке под основным шлаком СаО/SiO2>2 окисление кремния происходит практически необратимо из-за связывания продукта реакции в прочный силикат кальция 2CaO·SiO2. При горячем ходе кислого процесса имеет место значительное восстановление кремния.
Поведение марганца
Марганец по своим свойствам близок к железу, растворяется в нем в любых соотношениях, образуя раствор, очень близкий к идеальному. При низких температурах сталеплавильного процесса в окислительных условиях марганец окисляется с выделением теплоты, переходя в шлак. Реакции окисления марганца можно представить в виде
[Mn] + [O] ↔ (MnO) + Q; [Mn] + (FeO) ↔ (MnO) + [Fe] + Q.
С повышением температуры и основности шлака марганец может частично восстанавливаться кремнием, углеродом и железом. Поскольку почти все стали содержат марганец, то его восстановление в процессе плавки явление желательное.
Поведение фосфора
Фосфор является вредной примесью, ухудшает механические свойства стали при температурах ниже 0°С и вызывает явление, называемое хладноломкостью. Главным источником поступления фосфора в металл при сталеплавильном процессе является чугун, часть фосфора поступает из железного лома и ферросплавов. Окисление растворенного в металле фосфора схематически можно представить в виде
2[P] + 5(FeO) = (P2O5) + 5[Fe] + Q.
Окисление и переход фосфора в шлак сопровождаются выделением теплоты. В связи с этим, например, в томасовском процессе фосфор является основным источником теплоты, под действием которой происходит нагрев металла. Поскольку реакция окисления фосфора экзотермическая, то удаление фосфора из металла стремятся проводить при умеренных температурах. При повышении температуры возможно восстановление фосфора и переход его в металл за счет углерода, кремния, марганца и железа. Фосфор можно удержать в шлаке, повысив основность шлака, введением СаО. При этом в шлаке образуются устойчивые соединения, например, 3СаО.Р2О5, снижающее активность фосфора в шлаке. Таким образом, суммарный процесс перехода фосфора в шлак можно представить в виде
2[P] + 5(FeO) + 3(СаО) = 3СаО.Р2О5 + 5[Fe] + Q.
Для удаления фосфора из металла необходимо обеспечить быстрое формирование железисто-известкового шлака. Это условие необходимое, но недостаточное. При высоких содержаниях фосфора в металлической шихте после того, как фосфор окислился и значительная часть его перешла в шлак, последний необходимо удалить из сталеплавильного агрегата и навести новый присадкой шлакообразующих материалов. Увеличением количества шлака можно снизить содержание фосфора в металле, однако ведение процесса с большими массами шлака связано с увеличением потерь железа и требует дополнительных затрат энергии и времени, поэтому к такой мере прибегают лишь при крайней необходимости.
Поведение серы
Сера является вредной примесью, придает металлу красноломкость, связанную с выделением при кристаллизации стали в межзеренном пространстве сульфидов железа, которые с железом образуют эвтектику, плавящуюся при температурах 988 °С, которая в присутствии кислорода (образование оксисульфидов) плавится при еще более низких температурах. Слиток стали, содержащий большое количество серы, разрушается при пластической обработке (горячая ковка, штамповка, прокатка) в условиях температур 1200-1250 °С. При этом прослойки, разобщающие зерна стали, находятся в жидком состоянии и способствуют разрушению металла при его деформации. Источниками серы являются шихтовые материалы и, главным образом, чугун. Часть серы содержится в стальном ломе и шлакообразующих материалах. Сера является поверхностно-активным элементом и на поверхностях раздела фаз концентрация ее всегда выше, чем в объеме растворов. Для перевода серы из металла в шлак наиболее эффективным является увеличение поверхности контакта металла со шлаком или другой десульфурирующей фазой (например, вдуваемые в металл тонкоизмельченные порошкообразные реагенты). Переход серы из металла в шлак проходит на границе раздела. Удаление серы из металла в шлак происходит по реакции
(СaО) + [FeS] = (CaS) + (FeO).
Повышение основности и снижение окисленности шлака способствуют десульфурации. Положительную роль оказывает также повышение температуры металла и активное перемешивание ванны.
Газы в стали
Газы Н2, N2, O2 ухудшают качество стали, снижая ее механические свойства. При избыточном содержании кислорода в стали образуются не только пузыри СО в результате взаимодействия с углеродом, но и легкоплавкие оксидные и оксисульфидные включения. Азот снижает пластические свойства стали. Водород способствует появлению таких дефектов, как флокены, шиферный излом и т. п.
Процесс растворения газов в жидком металле, контактирующем непосредственно с газовой фазой, сопровождается диссоциацией молекул на атомы. Так, для водорода можно записать этот процесс в виде {Н2} = 2[Н].
Константа равновесия этой реакции 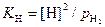 , откуда
, откуда 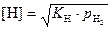 .
.
Таким образом, при данной температуре растворимость водорода в железе пропорциональна квадратному корню из парциального давления водорода в газовой фазе. Растворимость водорода в железе с повышением температуры возрастает.
Однако в различных модификациях твердого железа растворимость его различна. Присутствие примесей изменяет растворимость водорода в металле. Такие элементы, как углерод, кремний, бор, алюминий снижают, а титан, ванадий повышают растворимость водорода в металле. Слабо влияют на растворимость водорода в металле никель, хром, марганец, кобальт, молибден.
Скачкообразное изменение растворимости водорода при переходе из одной модификации железа в другую обусловливает выделение водорода из металла, нарушение его сплошности и образование мельчайших дефектов, называемых флокенами. Водород, присутствующий в твердом растворе, увеличивает хрупкость металла вследствие искажения его кристаллической решетки, одновременно снижая пластичность. Это отрицательно влияет на служебные свойства металла.
Растворимость азота в железе, контактирующим с газовой фазой при заданной температуре, также пропорциональна квадратному корню из парциального давления в атмосфере, находящейся над расплавом, т. е. можно записать {N2} = 2[N], 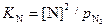 ,
, 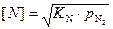 .
.
С повышением температуры растворимость азота в модификациях α-Fе и δ-Fе растет. В отличие от водорода, растворимость азота в модификации γ-Fе с повышением температуры снижается. В различных модификациях железа растворимость азота также различна. Это приводит к скачкообразному изменению растворимости азота в металле при его охлаждении. Очень сильное снижение растворимости азота при переходе металла из жидкого состояния в твердое и при превращении γ-Fе в α-Fе особенно при высоких скоростях охлаждения способствует образованию перенасыщенного азотом твердого раствора. Из этого раствора в процессе службы изделий из такого металла выделяются нитриды по границам зерен, повышающие твердость и хрупкость металла и снижающие его пластичность. Это явление называют старением металла, проявляющимся при эксплуатации изделий из него в условиях низких температур. Для предотвращения последнего необходимо использовать чистые по содержанию азота шихтовые материалы, создать условия для интенсивного кипения металла в процессе выплавки, осуществлять продувку инертным газом, вакуумирование и т. п. Присутствующие в металле титан, ванадий, ниобий, церий, хром заметно повышают, а углерод, никель, фосфор, кремний снижают растворимость азота в железе.
В твердом железе растворимость кислорода невелика. Например, в твердой фазе δ-Fе при температуре плавления железа в равновесных условиях может содержаться не более 0,043 % [О], а в γ-Fе в десять раз ниже. Растворимость кислорода в α-Fе не превышает 0,002 %. После кристаллизации расплава избыточный кислород (сверх равновесного в α-Fе) переходит в оксидные неметаллические включения (МnО, SiO2, Аl2О3 и т. п.), образующиеся после введения раскислителей, обладающих более высоким химическим сродством к кислороду, чем железо. Такие включения находятся в жидкой стали, их температура плавления превышает температуру последней, поэтому они в значительной части относятся к твердофазным.
Наряду с оксидными включениями, в стали присутствуют включения, представляющие собой сульфиды (FеS, МnS и т.п.), карбиды (Fе3С, Мn3С, Сг3С2 и т.п.), нитриды (ZrN2, VN, TiN и т.п.), фосфиды (Fе3Р, Fе2Р и т.п.), а также комплексные включения типа оксисульфидов, карбонитридов, силикатов и т. д., образующиеся в ходе технологического процесса производства жидкой стали и ее кристаллизации после разливки.
Источниками неметаллических включений могут быть также шихтовые материалы, огнеупоры, легирующие добавки. Неметаллические включения, образующиеся в результате протекания реакций в жидком или затвердевающем металле, называют эндогенными (природными), а внесенные со стороны в готовом виде - экзогенными (случайными). Обычно в готовой стали может содержаться до 0,02 % оксидных включений, хотя в расплавленном металле их значительно больше.
Неметаллические включения ухудшают механические и другие свойства стали (магнитную проницаемость, электропроводность и т.п.), так как нарушают сплошность металла и образуют полости, в которых концентрируются напряжения в металле.
Дата добавления: 2017-06-13; просмотров: 2709;











