Геохимические группы химических элементов по Вернадскому
(с дополнениями Гаврусевича)
| Группа | Химические элементы | Количество элементов | Доля от общего количества элементов (111), % | Общая масса группы элементов в земной коре, т | Доля от общей массы земной коры, % | |
| Номер | Название | |||||
| I | Элементы благородных газов | He, Ne, Ar, Kr, Xe | 4,51 | 1014 | 5∙10-4 | |
| II | Элементы благородных металлов | Ru, Rh, Pd, Os, Ir, Pt, Au | 6,31 | 1012 | 5∙10-6 | |
| III | Циклические (миграционные) элементы | H, (Be), B, C, N, O, F, Na, Mg, Al, Si, P, S, Cl, K, Ca, Ti, V, (Cr), Mn, Fe, Co, (Ni), Cu, Zn, (Ge)?, As, Se, Sr, (Zr)?, Mo, Ag, Cd, (Sn), (Sb), (Te), Ba, (Hf), (W), (Re), (Hg), (Tl), (Pb), (Bi) | 39,64 | 2∙1019 | 99,8 | |
| IV | Рассеянные элементы | Li, Sc, Ga, Br, Rb, Y, (Nb), (Tc), In, I, Cs, Ta | 10,81 | 1016 | 5∙10-2 | |
| V | Сильно радиоактивные элементы | Po, At, Rn, Fr, Ra, Ac, Th, Pa, U, Np, Pu | 9,91 | 1015 | 5∙10-3 | |
| VI | Элементы редких земель | La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu | 13,51 | 1016 | 5∙10-2 | |
| VII | Элементы, по-видимому, вымершие в земной коре, но известные в космосе | Am, Cm, Bk, Cf | 3,60 | – | – | |
| VIII | Элементы неизвестные в природе, полученные искусственно | Es, Fm, Md, No, Lr, Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg | 11,71 | – | – |
Б.А. Гаврусевич в 1968 году в учебном пособии «Основы общей геохимии» дал следующие пояснения к этой классификации.
Группа I включает элементы, которые не принимают участия в главнейших геохимических процессах земной коры и не образуют химических соединений с другими элементами, за исключением космической обстановки. Они инертные, и не вступают в химические соединения. Их геохимическое значение очень велико (особенно Не в условиях космоса). Количество гелия в земной коре изменчиво, оно, с одной стороны, увеличивается в результате процессов радиоактивного распада; с другой стороны — гелий уходит в космос («гелиевое дыхание» земной коры, по В.И. Вернадскому).
Группа II включает два ряда восьмой группы короткой 8-ми клеточной таблицы периодической системы химических элементов[13]; сюда же относится золото Аu. Из благородных металлов в лабораториях получают множество устойчивых химических соединений, и этим они отличаются от благородных газов. В земной коре благородные металлы почти не образуют химических соединений, за очень редким исключением: Pt — спериллит PtAs2, бреггит (Pt, Pd)S и куперит PtS; Pd — редкий минерал палладинит PdO; Au — редкие теллуриды: петцит (Au, Ag)2Te, сильванит AuAgTe4, креннерит (Au, Ag)Te2, калаверит AuTe2 и др. Эти минералы мало изменяются или почти не изменяются в течение геологического времени.
Группа III включает наибольшее число химических элементов и образует почти всю земную кору. Элементы этой группы образуют многочисленные химические соединения, участвуют в различных процессах земной коры ... и в большинстве своём характеризуются повышенной способностью к миграции. Основная масса элементов третьей группы играет большую роль в биогенных процессах, причём не только такие органогенные элементы, как С, О, N, Н, Р, S, но и целый ряд элементов-металлов (Fe, Сu, Zn, V, Мn и др).
В природе циклические элементы образуют большое количество относительно устойчивых минералов, способных накапливаться в значительных по масштабам скоплениях. Однако, за исключением элементов, слагающих основу земной коры, главная масса атомов элементов третьей группы, находится в земной коре в "рассеянном" состоянии в чужих кристаллических решётках.
Группа IV охватывает элементы, которые в земной коре находятся преимущественно в состоянии рассеяния, состоянии свободных атомов, ионов и комплексов в чужих кристаллических решётках. Рассеянные элементы, за редким исключением, не дают самостоятельных минеральных видов.
Группа V включает сильно радиоактивные элементы, которые находятся в рядах (семействах) радиоактивного распада тория Th, урана U, актиния Ac и нептуния Np и образуются в результате распада «родоначальников», в то же время они и сами распадаются, превращаясь в радиоактивные нуклиды других химических элементов. Совместное нахождение сильно радиоактивных элементов в земной коре обусловливается именно генетическими причинами — радиоактивным распадом. Торий и уран образуют самостоятельные минералы, но большинство их атомов находится в земной коре в состоянии рассеяния. Остальные радиоактивные элементы находятся только в состоянии рассеяния.
Группа VI занимает в короткой (8-ми клеточной) таблице периодической системы химических элементов особое место – одну клетку. За исключением иттрия 39Y, это редкие земли от лантана 57La до лютеция 71Lu, которые характеризуются чрезвычайной близостью химических и геохимических свойств благодаря специфическому строению электронных оболочек их атомов. Редкоземельные элементы образуют совместно ряд минералов в магматогенных процессах и, встречаясь совместно, различаются лишь количественными соотношениями.
Группы VII и VIII включают химические элементы, не обнаруженные в земной коре и вообще в природе, хотя технеций 43Тс, например, уже обнаружен в космических телах (возможно, будут обнаружены америций 95Am, кюрий 96Cm, берклий 97Bk и калифорний 98Cf). По своим свойствам атомы химических элементов очень краткосрочно живущие; эти элементы как бы «вымерли» в земной коре, но могут быть обнаружены в мантии Земли.
Масса элементов каждой из указанных геохимических групп в земной коре (в тоннах) следующее:
- благородные газы — 1014;
- благородные металлы — 1012;
- циклические элементы — 1018-1019, близко к 2 ∙ 1019;
- рассеянные элементы — 1016;
- радиоактивные элементы — 1015;
- редкоземельные элементы[14] — 1016.
Эти данные являются первым приближением к действительности, но порядок они показывают довольно точно. Циклические элементы образуют почти всю массу земной коры, больше 99,7 %, но небольшой остаток (0,3 %) остальных элементов — тоже величина не малая. Она составляет квадрильоны (1015) тонн. И эти элементы играют важную роль в геохимической жизни земной коры.
В.М. Гольдшмидт геохимическую классификацию химических элементов (1924), исходя из предположения о том, что распределение элементов в земной коре находится в связи с их физическими и химическими свойствами и особенно с их поведением в кристаллических решётках. Поэтому его геохимическая классификация учитывает радиусы ионов элементов и характер их типичных химических соединений. Гольдшмидт подразделил химические элементы на группы в соответствие с устойчивостью различных типов их соединений в природе. В основу им были положены законы распределения элементов по трём принципиальным фазам метеоритов: сикикатной (кислородной), сульфидной и металлической. "Эталоном", относительно которого классифицируются элементы является Fe – элемент с высокой распространённостью, входящий в состав всех принципиальных фаз метеоритов (рис. ).
Литофильные элементы (от «литос» – камень и «филео», буквально «камнелюбивые»), обогащающие силикаты. Эта самая обширная группа половины всех известных в природе. Атомы этих элементов образуют ионы со строением внешнего электронного слоя атома предшествующего благородного газа. Все они располагаются на нисходящих ветвях кривой атомных объёмов химических элементов. Всем им присущи химические соединения с кислородом и серой.
Такие элементы с лёгкостью образуют кислородсодержащие минералы и составляют основу большинства горных пород. В свободном состоянии в земной коре не встречаются.
Халькофильные элементы (от «халькос» — медь и «филео», буквально «меднолюбивые»), обогащающие сульфиды: S, Se, Te, Bi, Cd, In, Tl, Сu, Zn, Ag, Au, Ge, Hg, Pb, Sb, As и другие (всего их 19). Легко вступают во взаимодействие с серой и её аналогами – селеном и теллуром, и в виде таких химических соединений наиболее часто находятся в земной коре. Некоторые существуют в природе в виде простых веществ. Эти элементы имеют сравнительно большой объём и располагаются на восходящих ветвях кривой атомных объёмов, а их ионы имеют 18-ти электронную наружную оболочку.
Сидерофильные элементы (от «сидерос» – железо и «филео» –люблю, имею склонность, буквально «железолюбивые»), обогащающие металлическую фазу: Ni, P, C, Со, Mo, Pt, Ir, Os, Ru, Rh, Pd, Au. В эту группу из 11 элементов, входят кроме железа элементы VIIIБ группы периодической системы, их атомные объёмы минимальны, а ионы имеют недостроенную 18-электронную оболочку. Большинство из них встречается в самородном состоянии.
Атмофильные элементы (от "атмос" – пар и "филео", то есть паролюбивые), слагающие земную атмосферу (O, N, благородные, или инертные, газы), обладают ковалентными связями в молекулах и минимальными атомными радиусами. Инертные газы напротив обладают максимальными размерами атомов и завершёнными наружными электронными оболочками.
Ряд элементов с промежуточными свойствами попали в несколько групп: Ga, Ge, Sn, Nb, Ta, W. Кроме того, Гольдшмидт выделил дополнительную группы элементов: атмофильные элементы, для которых характерно в условиях земной поверхности газообразное состояние и накопление в атмосфере (Н, N, С, О, Cl, Br, I и инертные газы), и биофильные элементы, являющиеся главными компонентами организмов (С, Н, О, N, Р, S, Cl, I, В, Са, Мg, К, Na, V, Mn, Fe, Сu). Повторение элементов в разных группах естественно, поскольку при выделении дополнительных групп использованы разные принципы. Эта классификация позволяет предсказать главный тип химических соединений элементов в природе и тем самым факторы, приводящие к их концентрации. Так, халькофильные элементы в подавляющей массе концентрируются в виде основных и примесных компонентов в сульфидных рудных месторождениях; большинство сидерофильных элементов (Au, группа Pt) концентрируются в самородном состоянии; литофильные элементы накапливаются в составе главных или второстепенных минералов магматических и осадочных пород.
К классификации Гольдшмидта добавлена пятая группа элементов — гидрофильных, куда входят Na, К, Mg, Са и др., атомы которых обладают максимальными радиусами и образуют простые вещества с прочными кристаллическими решётками.
В.М. Гольдшмидт несколько упрощённо объяснял распределение химических элементов в земном шаре на основе атомных объёмов. По его мнению, в центре Земли должны находиться сидерофильные элементы (Fe, Со, Ni), обладающие наименьшим атомным объёмом.
В 1921 г. для объяснения геохимических проблем А.Е. Ферсман впервые применил Периодическую систему химических элементов Д.И. Менделеева, на основе которой составил несколько таблиц, отражающих геохимические свойства элементов. Таблица 5 – одна из них.
Таблица 5
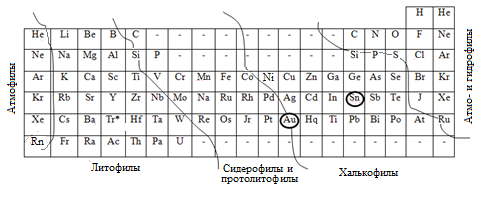
Сопоставление свойств химических элементов в периодической системе Д.И. Менделеева чётко вырисовывает три направления аналогий:
- вертикальное, отражающее естественные группы и подгруппы элементов по признаку сходства поведения их валентных электронов;
- горизонтальное, отражающее постепенность изменения химических свойств элементов внутри периода, характеризующегося соответствующим главным квантовым числом;
- диагональное (из левого верхнего угла в правый нижний), отражающее близость элементов по размерам их атомов и ионов, а также по величине электроотрицательности.
На основании приведённых аналогий Ферсман выделил в периодической системе химических элементов геохимические поля (геохимические ассоциации) (табл. 5), в которых проявляется общность судеб элементов в геохимических процессах, приводящих их к распределению в земной коре.
Ферсман понимал, что «...именно ионы определяют собой пути миграции химических элементов». Поэтому он подвергал сравнению в первую очередь свойства ионов. Такое сравнение позволило сформулировать правило диагональных рядов изоморфного замещения, а для каждого химического элемента построить «звезду изоморфизма» – схему наиболее вероятной изоморфной совместимости.
Явление изоморфизма, или изоморфной совместимости, заключается в том, что частицы (атомы, ионы), достаточно близкие по своим объёмам (различие не более чем на 15 %) и способные образовывать соединения со сходным типом химических связей, могут замещать друг друга в кристаллических решётках. При этом образуются смешанные кристаллы переменного состава, называемые твёрдыми растворами замещения. Так, множество природных соединений изображают «идеализированными» химическими формулами. Например, в кристаллической решётке серного, или железного, колчедана, который изображается формулой FeS2, некоторая часть атомов железа F(II) может быть замещена атомами кобальта Со и никеля Ni, в той же степени окисления, а часть атомов серы — атомами селена Se и теллура Te. Число таких заместителей непостоянно, оно колеблется в довольно широких пределах в зависимости от характера месторождения серного колчедана. Правильнее такой колчедан изображать формулой Fe(Co, Ni)S2(Se, Te).
Явление изоморфного замещения во многом объясняет встречающиеся в природе сочетания химических элементов, которые отражают общность комплекса физико-химических свойств элементов и определённые сходства в электронной структуре их атомов.
Круговорот, перемещение, перераспределение концентраций и перегруппировка атомов химических элементов происходит под действием сложной совокупности семи основных энергетических факторов.
1. Энергия тяготения (гравитационные силы) служит причиной перемещения растворов и сыпучих материалов, причиной гравитационной дифференциации химических элементов по их атомным массам. Считается, что вследствие действия именно этих сил континенты (материки) в земной коре сложены из более лёгких химических элементов, чем подстилающие их горные породы.
2. Энергия радиоактивных превращений приводит к изотопному обмену, к возникновению одних атомных форм и «вымиранию» других. Если принять процессы ядерных превращений за источник разогретости внутренних слоев Земли, то роль энергии радиоактивных превращений в геохимических процессах просто невозможно переоценить.
3. Лучистая энергия проявляется в световом давлении, в управлении фотохимическими процессами. Именно в виде лучистой энергии передаётся энергия Солнца Земле. Этот вид энергии рождает весьма важный в геохимическом отношении процесс фотосинтеза (рис. ).
4. Электромагнитная энергия связана со структурой валентных электронных слоёв (энергетических уровней). Именно эта энергия определяет характер химических связей химические и электрохимические превращения, кристаллизацию и растворимость веществ, их поверхностную активность. В свою очередь химические связи определяют молекулярные формы сочетания и существования химических элементов. От свойств кристаллических структур зависит, в каких условиях и в какой последовательности начинается выделение твёрдой фазы из расплавленных магматических масс. Растворимость веществ в воде и их устойчивость к химическим превращениям определяет геохимические судьбы и миграционные пути химических элементов в воде. Так, например, способность атомов химического элемента образовывать ковалентные связи приводит к возникновению сложных ионов. В виде таких ионов существуют: золото Au, серебро Ag, медь Cu, ртуть Hg, марганец Mn, железо Fe, кобальт Co, никель Ni, цинк Zn, уран U, цирконий Zr и другие элементы. Причём каждому сложному иону соответствуют определённые границы значений рН, при которых он может находиться в растворе и вне которых образует с противоинами нерастворимые химические соединения, выпадающие в осадок.
5. Тепловая энергия определяет процессы на молекулярном уровне: диффузию и изменение агрегатного состояния вещества. В зависимости от различия температур плавления и кипения и характера химических связей, возникающих в соединениях элементов, поступающая извне тепловая энергия по разному сказывается на геохимических судьбах элементов. Так, для простых веществ с температурой кипения меньше 400 °С летучесть является главным фактором миграции элементов в геохимических процессах. Летучестью обладают галогены, галогениды некоторых металлов, ртуть, фосфор. Простые вещества обладающие низкими температурами кипения, также отличаются общностью геохимических свойств (атмофильные кислород и азот).
6. Кинетическая энергия движущихся масс космического вещества и перемещающихся потоков веществ земной коры вовлекает в движение огромное количество соединений химических элементов.
7. Физико-химическая энергия живого вещества включает воздействие растительного и животного мира на геохимические процессы, а также всё возрастающую силу воздействия на природу со стороны человеческого общества.
С учётом перечисленных факторов следует различать две группы геохимических процессов, происходящих в земной коре: эндогенные (от греч. ēndon — внутри) — внутренние, вызываемые глубинными силами (тепловыми, гравитационными, ядерными и химическими), и экзогенные (от греч. exō – снаружи, вне) — внешние, которые происходят при взаимодействии литосферы с атмосферой, гидросферой, живыми организмами и солнечным излучением.
Именно в сочетании этих сложных взаимодействий в полях одновременного действия многих разнохарактерных сил концентрируются и рассеиваются атомы химических элементов, возникают месторождения драгоценных металлов и полиметаллических руд, россыпи самоцветов и пласты каменной соли (NaCl), каменноугольные и железорудные бассейны, целые геохимические провинции и ландшафты.
Рассмотрим некоторые наиболее распространённые в земной коре химические процессы.
Выветриванием[15] принято называть процессы разрушения и изменения горных пород под воздействием атмосферы, грунтовых и поверхностных вод, живых организмов. Эти процессы существенно зависят от климата. Физическое выветривание приводит лишь к измельчению горной породы, тогда как химическое выветривание сопровождается глубокими качественными изменениями её состава. Процессы химического выветривания происходят под действием воздуха и воды, насыщенной кислородом и углекислым газом.
Наиболее растворимые соли (см. приложение 2 – «Растворимость кислот, оснований и солей в воде»), такие, как хлориды, сульфаты и нитраты натрия, калия, магния и других металлов (например, NaCl, Na2SO4, NaNO3) могут скапливаться в виде твёрдого вещества только в местах, недоступных проникновению влаги. В противном случае эти химические соединения переходят в раствор и выносятся реками в моря. При определённых условиях испарение морской воды может приводить к осаждению больших количеств растворённых в ней солей. Пример такого процесса в современных условиях наблюдается в заливе Кара-Богаз-Гол (Каспий, Казахстан), где запасы сульфата натрия (мирабилита) исчисляются миллиардами тонн.
Даже малорастворимые в воде карбонат и сульфат кальция весьма заметно растворяются в воде, содержащей углекислый газ.
CaCO3 + H2O + 2CO2 = Ca(HCO3)2;
CaSO4 + H2O + 2CO2 = Ca(HCO3)2 + H2SO4.
Проникая в почву, в горные породы, вода вымывает в известняках (CaCO3) и доломитах (CaCO3 ∙ MgCO3) большие пещеры. Примером тому могут быть Сатаплийские пещеры вблизи Кутаиси (Грузия), тянущиеся под землей на многие километры и украшенные гирляндами сталактитов[16], сталагмитов[17] и сталагнатов[18].

Рис. . Сталактиты, сталагмиты и сталагнаты
(Национальный парк Карлсбадские пещеры)
Но вода не только растворяет и переносит в земной коре вещества. Она является средой, в которой происходят многие химические превращения, она может быть и участником этих химических реакций. Особенно важными являются процессы окисления атомов, комплексообразования и гидратации минералов и горных пород. В таких процессах многие химические элементы меняют степень окисления (Fe+2 → Fe+3; S° → S-3), превращаясь из одних минеральных форм в другие. Подобные процессы усиливаются жизнедеятельностью бактерий и происходят на глубинах до 60 и даже до 300 метров.
Под влиянием воды в земной коре происходит наиболее распространённый процесс гидролиза. Именно гидролиз переводит в растворимую форму щелочные элементы-металлы из силикатов (таких, как полевой шпат К2О · Al2O3 · 6SiO2) с последующим превращением их в слюды или глины. Схему этого процесса можно изобразить так:
K2O·Al2O3·6SiO2 → KH2Al2Si3O12 → H2Al2Si2O8·H2O → Al2O3·H2O и SiO2·nH2O.
полевой шпат серицит каолин боксит опал
Приведённая схема подтверждает справедливость закона В. Оствальда: всякая химическая система при переходе в более устойчивое состояние совершает этот переход по ступеням, постепенно занимая уровни всё большей и большей устойчивости.
Этот закон для геохимии имеет исключительно большое значение, так как характеризует направление химической эволюции неживой материи в сторону образования наиболее стабильных химических соединений, обладающих минимумом энергии.
А.Е. Ферсман отмечал, что в природе также характерным является наличие минералов переменного состава — «мутабильных[19] соединений», которые:
– не обладают определённым стехиометрическим составом и не подчиняются закону рациональных отношений;
– являются вместе с тем однородными и составляют одну фазу;
– изменяют свой состав в геохимических процессах без скачков, постепенно;
– являются промежуточными продуктами длительных геохимических превращений, постепенно переходя в более определённые минеральные виды. Примером таких превращений может быть превращение пирита (серный, или железный, колчедан) в лимонит:
FeS2 → Fe2 (SO4)3 → KFe(ОH)2(SО4)2 → Fe2O3 · H2O → Fe2O3 · nH2О.
пирит железный розит гётит лимонит
купорос
Таким образом, можно сделать вывод, что распределение и миграция химических элементов зависят от устойчивости их соединений в соответствующих природных условиях.
В 1923 году, обобщая накопленные наукой данные, В. М. Гольдшмидт сформулировал закон, известный под названием основного закона геохимии «Абсолютное количество (химического) элемента зависит от ядра (его атомов), распределение элемента — от наружных электронов (его атомов)». То есть количество атомов элементов, присутствующих в том или ином космическом объекте, связано со строением и процессами превращения атомных ядер. Вместе с тем, формы, в которых элементы встречаются в природе, определяются их химическими свойствами.
Однако следует подчеркнуть лишь относительную справедливость закона Гольдшмидта: на распространённость и распределение химических элементов решающим образом влияют не только их индивидуальные свойства, присущие ядрам и электронным оболочкам их атомов, но и условия среды, в которой эти атомы существуют.
А.Е. Ферсман показал, что кларк химического элемента «... есть функция времени и места...» в космическом пространстве. Предсказания эти подтверждаются данными о составе лунных пород, полученных американскими астронавтами, и данными по химическому составу атмосферы Венеры и Марса, полученными с помощью космических кораблей нашей страны. Эти данные существенно отличаются от того, что наблюдается в земных коре и атмосфере.
Следует отметить, что и факторы, определяющие геохимическую эволюцию химических элементов, в течение геологического времени также подверглись существенным переменам. Если А.Е. Ферсман рассмотрел этапы истории атомов химических элементов в природе, то профессор А.А. Сауков изучил эволюцию факторов, определяющих геохимические миграции. Так оказались заложенными основы новой науки — исторической геохимии.
Д.И. Менделеев утверждал: «...роль наук служебная, они составляют средство для достижения блага». Эти слова «отца современной химии» в полной мере относятся к геохимии.
От геохимии ждут научно обоснованных методов поисков полезных ископаемых, рекомендаций по рациональному размещению производственно-промышленных комплексов, разработки способов наиболее рационального использования химических элементов, исследования проблем охраны природы. От геохимии ждут и новых больших теоретических обобщений, ибо «нет ничего более практичного, чем хорошая теория».
Дата добавления: 2017-06-13; просмотров: 2630;











