СВЯЗЬ РАСПРОСТРАНЁННОСТИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ С ПОЛОЖЕНИЕМ ИХ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ И УСТОЙЧИВОСТЬ АТОМОВ ЭЛЕМЕНТОВ
Для геохимии важно выяснить принцип распространения химических элементов в земной коре. Почему одни из них часто встречаются в природе, другие значительно реже, а третьи вообще представляют собой «музейные редкости»?
Мощным инструментом для объяснения многих геохимических явлений служит Периодический закон Д.И. Менделеева. В частности с его помощью может быть исследован вопрос о распространённости химических элементов в земной коре.
Впервые связь геохимических свойств элементов с положением их в Периодической системе химических элементов показали Д.И. Менделеев, В.И. Вернадский и А.Е. Ферсман.
Правила (законы) геохимии
Правило Менделеева
В 1869 году, работая над периодическим законом, Д.И. Менделеев сформулировал правило: «Элементы с малым атомным весом в общем более распространены, чем элементы с большим атомным весом» (см. приложение 1, Периодическую систему химических элементов). Позднее, с раскрытием строения атома было показано, что у химических элементов с малой атомной массой число протонов приблизительно равно числу нейтронов в ядрах их атомов, то есть отношение этих двух величин равно или близко к единице: для кислорода 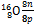 = 1,0; для алюминия
= 1,0; для алюминия 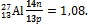
У менее распространённых элементов в ядрах атомов преобладают нейтроны и отношение их числа к числу протонов существенно больше единицы: для радия 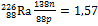 ; для урана
; для урана 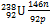 = 1,59.
= 1,59.
Дальнейшее развитие «правило Менделеева» нашло в работах датского физика Нильса Бора и российского химика, академика АН СССР Виктора Ивановича Спицына.

| Виктор Иванович Спицын (1902-1988) |
Правило Оддо
В 1914 году итальянский химик Джузеппе Оддо сформулировал другое правило: «Атомные веса наиболее распространённых элементов выражаются числами, кратными четырём, или мало отклоняются от таких чисел». Позднее это правило получило некоторую трактовку в свете новых данных о строении атомов: ядерная конструкция, состоящая из двух протонов и двух нейтронов [2р + 2n = Не2+ (альфа-частица, гелион] обладает особой прочностью.
Правило Гаркинса
В 1917 году американский физикохимик Уильям Дрепер Гаркинс (Харкинс) обратил внимание на то, что химические элементы с чётными атомными (порядковыми) номерами распространены в природе в несколько раз больше, чем соседние с ними элементы с нечётными номерами. Подсчёты подтвердили наблюдение: из первых 28 элементов периодической системы 14 чётных составляют до 86 %, а нечётные — только 13,6 % от массы земной коры.
В этом случае объяснением может служить тот факт, что химические элементы с нечётными значениями атомного номера содержат частицы, не связанные в гелионы, а потому являются менее стабильными.
Из правила Гаркинса имеется много исключений: так, чётные благордные газы распространены крайне слабо, а нечётный алюминий Al обгоняет по распространению чётный магний Mg. Однако есть предположения, что это правило распространяется не столько на земную кору, сколько на весь земной шар. Хотя достоверных данных о составе глубинных слоёв земного шара пока нет, но некоторые сведения позволяют предполагать, что количество магния в целом в земном шаре вдвое больше, чем алюминия. Количество же гелия He в космическом пространстве во много раз превосходит его земные запасы. Это едва ли не самый распространённый химический элемент Вселенной.
Правило Ферсмана
А.Е. Ферсман наглядно показал зависимость распространённости химических элементов в земной коре от их атомного (порядкового) номера. Эта зависимость становится особо очевидной, если построить график в координатах: атомный номер — логарифм атомного кларка. На графике прослеживается чёткая тенденция: атомные кларки понижаются с увеличением атомных номеров химических элементов.
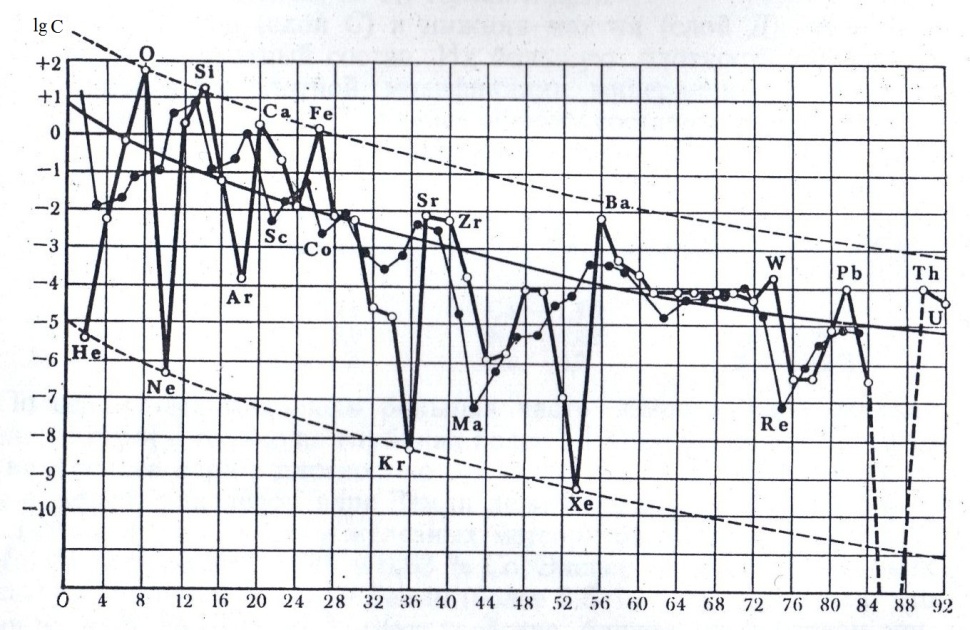
Рис. . Распространённость химических элементов в земной коре
(lg C – логарифмы атомных кларков по Ферсману)
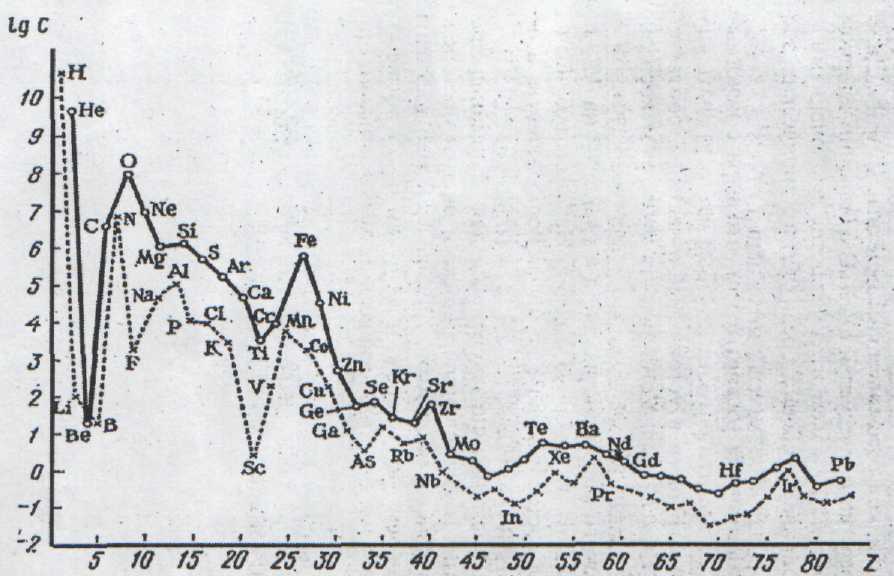
Рис. 5. Распространённость химических элементов во Вселенной
(lg C – логарифмы атомных кларков по Ферсману)
(данные о количестве атомов отнесены к 106 атомов кремния)
Сплошная кривая – чётные значения Z,
пунктирная – нечётные значения Z
Однако имеются и некоторые отклонения от этого правила: часть химических элементов значительно превосходит ожидаемые значения распространённости (кислород O, кремний Si, кальций Ca, железо Fe, барий Ba), а другие (литий Li, бериллий Be, бор B) встречаются много реже, чем следовало ожидать, исходя из правила Ферсмана. Такие химические элементы называются соответственно избыточными и дефицитными.
Формулировка основного закона геохимии дана на с .
Дата добавления: 2017-06-13; просмотров: 3561;











