Периодический закон и правило радиоактивного сдвига
Основные правила геохимии со всей очевидностью подтверждают отчётливую связь распространённости химических элементов в земной коре с их атомной массой и атомным номером, а следовательно, и с их положением в периодической системе Д.И. Менделеева.
В чём же причина этой связи? Сама периодическая система в её клеточной форме отражает связь между химическими элементами в застывшей форме. Она представляет как бы мгновенную фотографию, на которой запечатлён момент исторического развития химических элементов. Философ, химик и историк науки Бонифаций Михайлович Кедров говорил, что человеческая мысль движется по таблице, как по застывшей картине, и размещение химических элементов по клеткам не создаёт впечатления движения. Вместе с тем периодическая система химических элементов наталкивает на мысль о едином плане строения атомов элементов, о возможности их взаимных превращений, о том, что клетки таблицы являются как бы ступенями в развитии материи.
Открытие и объяснение явления радиоактивности подтвердило смутные догадки учёных XIX века. В законе радиоактивного сдвига, сформулированном английским радиохимиком Фредериком Содди и американским физикохимиком Казимиром Фаянсом, периодическая система химических элементов выступила уже не в статической, а в динамической форме.
Радиоактивностью (от лат. radio – излучаю и actives – действенный) называют самопроизвольное (спонтанное) деление атомных ядер – распад атомного ядра на 2 (реже 3 или 4) осколка; происходит лишь у тяжёлых элементов (например, у урана) и ограничивает возможность существования более тяжёлых трансурановых элементов. Такое деление открыто физиками: академиком АН СССР Георгием Николаевичем Флёровым (1913-90) и К.А. Петржаком неустойчивого нуклида одного химического элемента в нуклид другого элемента, сопровождающееся испусканием элементарных частиц или атомных ядер.
Периодом полураспада (Т1/2) называется время, за которое распадается половина исходного количества радиоактивного нуклида. В течение первого периода полураспада распадается 1/2 часть от первоначального числа ядер атомов нуклида N0 и остаётся 1/2 N0 = 2-1 N0 атомных ядер. В течение второго периода распадается половина от 2-1 N0 и остаётся 1/2∙2-1 N0 = 2-2 N0 ядер и т. д. В конце n-го периода полураспада остается 2-n N0 ядер атомов исходного нуклида. Аналогичное выражение справедливо для массы (m) нераспавшегося нуклида: m = 2-n m0, где m0 — исходная масса нуклида.
Пример. Период полураспада некоторого радиоактивного изотопа равен 3 ч. Какая масса его останется нераспавшейся через 18 ч, если первоначальная масса нуклида составляла 200 г?
Решение. За время хранения радиоактивного нуклида прошло 18/3 = 6 периодов полураспада. Отсюда масса нераспавшегося нуклида, оставшаяся после 18 ч хранения, равна:
m = 2-n m0 = 2-6 · 200 = 200/64 = 3,125 (г)
Уравнения реакций радиоактивного распада должны удовлетворять правилу равенства сумм индексов:
а) сумма массовых чисел частиц, вступающих в реакцию, равна сумме массовых чисел частиц — продуктов реакции; при этом массы электронов, позитронов и фотонов не учитываются;
б) суммы зарядов частиц, вступающих в реакцию, и частиц — продуктов реакции равны между собой.
К основным видам радиоактивного распада, происходящего в природе относятся α-распад, β- и β+-распады, электронный захват и спонтанное деление. Часто эти виды радиоактивного распада сопровождаются испусканием γ-лучей, то есть жесткого (с большой частотой волны) электромагнитного излучения.
Согласно Содди и Фаянсу, при α-распаде – испускании α-частицы (ядро атома гелия 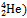 – гелион атомное ядро теряет два протона и два нейтрона, следовательно, заряд ядра уменьшается на 2, а массовое число на 4. Дочернее ядро принадлежит атому химического элемента, смещённого в периодической системе на две клетки к началу системы по отношению к материнскому элементу:
– гелион атомное ядро теряет два протона и два нейтрона, следовательно, заряд ядра уменьшается на 2, а массовое число на 4. Дочернее ядро принадлежит атому химического элемента, смещённого в периодической системе на две клетки к началу системы по отношению к материнскому элементу:
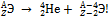
β--Распаду предшествует процесс 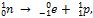 протекающий в атомном ядре; таким образом, при испускании электрона (β--частица) заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар[11] исходного – принадлежит атому химического элемента, смещенного на одну клетку к концу периодической системы от места материнского элемента:
протекающий в атомном ядре; таким образом, при испускании электрона (β--частица) заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар[11] исходного – принадлежит атому химического элемента, смещенного на одну клетку к концу периодической системы от места материнского элемента: 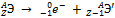 .
.
Позитронный распад. β+-Частица – позитрон (е+) – обладает массой электрона и зарядом, равным заряду электрона, но противоположным по знаку. Позитронному распаду предшествует ядерный процесс: 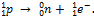 Число протонов в ядре при позитронном распаде уменьшается на единицу, а массовое число не изменяется. Образующееся ядро – изобар исходного ядра – принадлежит элементу, смещённому от материнского элемента на одну клетку к началу периодической системы.
Число протонов в ядре при позитронном распаде уменьшается на единицу, а массовое число не изменяется. Образующееся ядро – изобар исходного ядра – принадлежит элементу, смещённому от материнского элемента на одну клетку к началу периодической системы.
При электронном захвате атомным ядром электрона с ближайшего к нему K-слоя в ядре уменьшается число протонов вследствие протекания процесса: 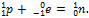
Заряд ядра уменьшается на единицу, а массовое число остаётся прежним. Дочернее ядро принадлежит атому химического элемента (изобар исходного элемента), смещённого по отношению к материнскому на одну клетку к началу периодической системы элементов:
При переходе периферийного электрона на освободившееся в К-слое место выделяется энергия в виде кванта рентгеновского излучения.
Таким образом, в законе радиоктивного сдвига периодическая система отразила процесс развития химических элементов. Поэтому можно сказать, что периодический закон Д.И. Менделеева по отношению к неживой (косной) природе сыграл ту же роль, что и дарвинизм по отношению к живой природе. Недаром английский учёный Уильям Крукс назвал открытие Менделеева «неорганическим дарвинизмом[12]».
Рассматривая исторический процесс развития и взаимного превращения химических элементов, легко прийти к выводу о том, что в природе должны накапливаться наиболее устойчивые структуры, и, наоборот, неустойчивые радиоактивные, короткоживущие конструкции обречены на неминуемое «вымирание».
Из атомной физики известно, что общая устойчивость атомных ядер падает с увеличением содержания в них нейтронов. Н. Бор ввёл параметр для определения устойчивости атомных ядер: если отношение Z2/A < 33, то ядра устойчивы (Z — атомный номер, А — массовое число); если отношение Z2/A > 33, то ядро неустойчиво и подвержено радиоактивным превращениям. В периодической системе висмут является последним химическим элементом, имеющим устойчивый нуклид 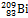 [исключение составляют два лёгких элемента: технеций Th (Z = 43) и прометий Pm (Z = 61), у которых нет ни одного устойчивого природного нуклида].
[исключение составляют два лёгких элемента: технеций Th (Z = 43) и прометий Pm (Z = 61), у которых нет ни одного устойчивого природного нуклида].
Из тех атомных ядер, для которых параметр Бора меньше 33, наиболее прочными являются ядра с чётным числом протонов, особенно сложенные из группировок (2р + 2n), то есть из α-частиц, или гелионов.
Многие учёные в мире ведут настойчивые поиски конструкции атомных ядер типа периодической системы, которая отразила бы закономерности строения, свойств и распространённости в природе устойчивых и неустойчивых нуклидов химических элементов. Создание такой системы поможет дать научное объяснение основным правилам геохимии Менделеева, Ферсмана, Оддо и Гаркинса, с несомненной очевидностью отражающих одну и ту же закономерность: распространённость химических элементов в земной коре, как и в целом во Вселенной, определяется свойствами ядер их атомов.
Дата добавления: 2017-06-13; просмотров: 1675;











