П. Реакции замещения
1.Альдегиды и кетоны при взаимодействии с РС15 обменивают атом кислорода карбонильной группы на два атома хлора, что используется для получения геминалъных дихлоралканов (по некоторым данным, аналогичная реакция идет и с РВr5):
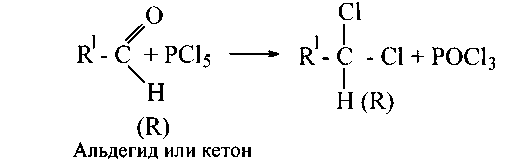
2. С гидроксиламином (NH2 - ОН) альдегиды и кетоны, выделяя воду, образуют оксимы (альдоксимы и кетоксимы):
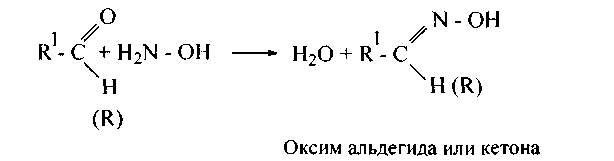
3. С гидразином (H2N—NH2) и его замещенными, например, фенилгидразином (H2N-NH-C6H5), альдегиды и кетоны дают гидразоны и фенилгидразоны:
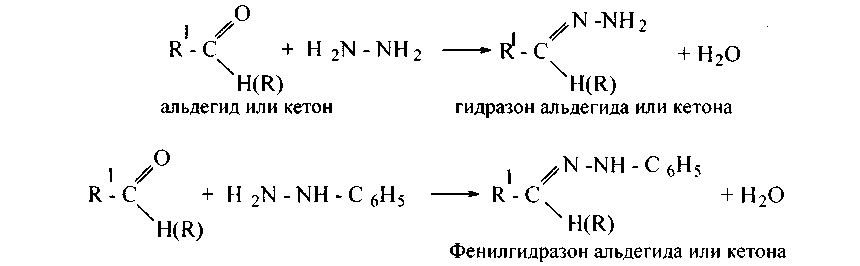
Оксимы, особенно гидразоны, фенилгидразоны, - кристаллические вещества. Они служат для качественного, количественного определения карбонильных соединений, а также для их выделения, очистки и идентификации.
В начале реакция представляет собой обычное нуклеофильное присоединение реагента к карбонилу, а затем происходит энергетически выгодная перегруппировка и отщепляется вода:
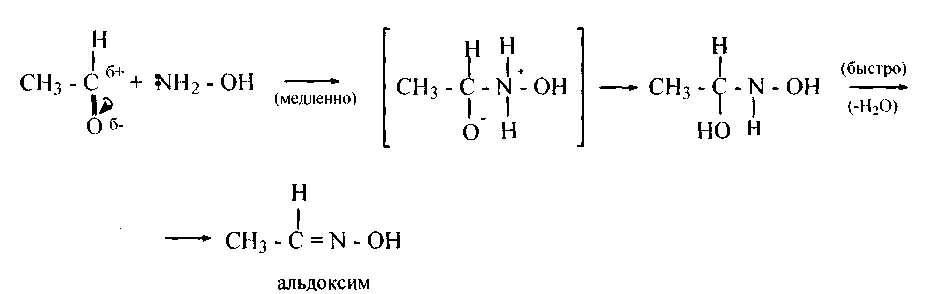
Аналогично идет реакция образования гидразонов, фенилгидразонов, семикарбазонов. В случае хлораля удалось выделить промежуточный продукт:
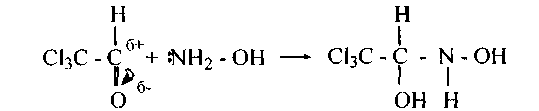
106.Напишите реакции (по стадиям) следующих веществ друг с другом и назовите полученные вещества: а) уксусный альдегид + фенилгидразин; б) пропионовый альдегид + РС15; в) ацетон + гидроксиламин; г) диизопропилкетон + PC15; д) бензойный альдегид + гидроксиламин; е) этилизопропил-кетон + фенилгидразин; ж) изомасляный альдегид + гидразин; з) уксусный альдегид + гидроксиламин; и) ацетон + фенилгидразин; к) ацетон + РС15.
III. Реакции с участием водорода α-положения
1. Галогенироваиие приводит к α-галогензамещенным альдегидам и кетонам. Большой положительный заряд карбонильного углерода способствует поляризации связи α-водородов, которые легко обмениваются при действии хлора или брома:
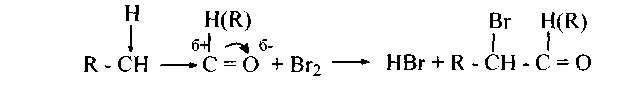
Механизм изучен на примере галогенирования ацетона, протекающего одинаково энергично при действии или хлора, или брома, или даже йода независимо от концентрации галогена. Реакция в щелочной среде идет более энергично, чем в кислой. В щелочной среде:
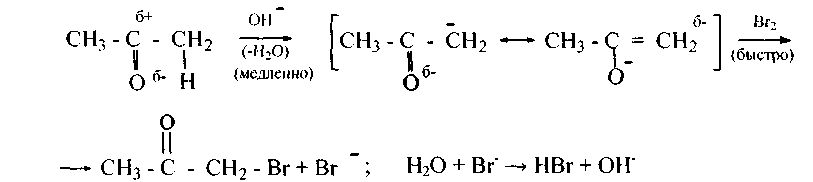
107.Приведите уравнения и механизм реакции галогенирования в щелочной среде следующих соединений: а) уксусный альдегид; б) изомасляный альдегид; в) метилэтилкетон; г) масляный альдегид; д) ацетон; е) метилизопропилкетон; ж) пропионовый альдегид; з) диэтилкетон.
2. Алъдолъная конденсация, протекающая в щелочной среде, обусловлена нуклеофильной атакой альдегида:
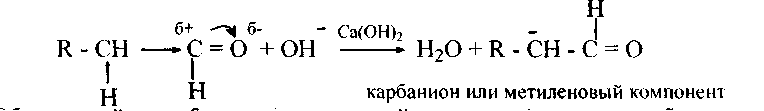
Образующийся карбанион (метиленовыи компонент) атакует карбонильный углерод другой молекулы (карбонильный компонент), и далее присоединяется протон Н+ из воды:
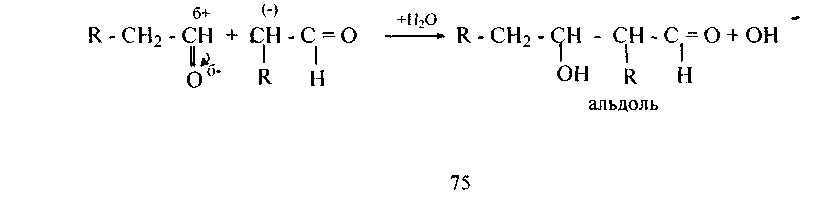
Реакция идет в присутствии небольшого количества NaOH или в среде Са(ОН)2, Ва(ОН)2, К2СО3, алкоголятов и др. Кетоны в такие реакции вступают с трудом, лишь наиболее активные из них способны к альдольной конденсации.
Если взять смесь двух альдегидов, то карбонильным компонентом является альдегид с более активным карбонилом, а метиленовым компонентом - с менее активным.
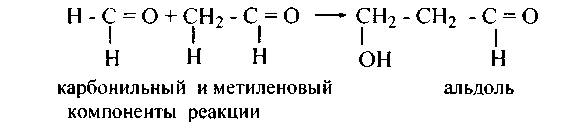
В смеси альдегида и кетона карбонильным компонентом является альдегид, а метиленовым - кетон.
Альдоли выделяют перегонкой в вакууме, ибо они легко теряют воду, образуя сопряженные π-связи (энергия сопряжения двух π-связей ~3-4 ккал/моль):
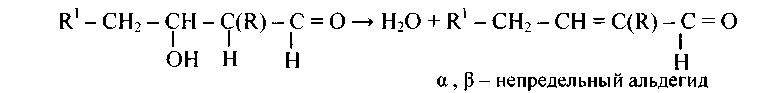
108.Напишите уравнения и механизм альдольной конденсации следующих смесей (или индивидуальных соединений) с образованием альдолов и α, β-непредельных альдегидов и кетонов:
а) пропионовый альдегид + Са(ОН)2; б) уксусный альдегид + ацетон + Ва(ОН)2; в) ацетон + Ва(ОН)2; г) изомасляный альдегид + Са(ОН)2; д) метанал + этанал + Са(ОН)2; е) уксусный альдегид + масляный альдегид + Ва(ОН)2; ж) пропионовый альдегид + ацетон + Са(ОН)2; з) метанал + бутанал-1 + Са(ОН)2.
IV. Восстановление альдегидовприводит к первичным, кетонов - к вторичным спиртам.
Например, при действии литийалюминийгидрида происходит нуклеофильное присоединение гидрид-иона (Н-), (1 моль LiAlH4 восстанавливает 4 моля альдегида или кетона), полученные соединения разлагают водой: ,
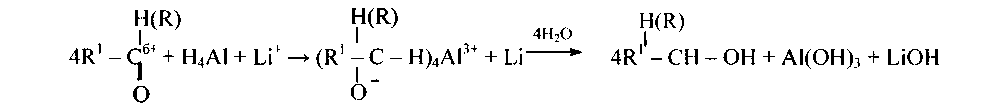
Литийалюминийгидрид подобно алкилмагнийгалогенидам легко гидролизуется водой и другими веществами. Восстановление ведут в среде абсолютного эфира или тетрагидрофурана. Механизм нуклеофильный, аналогичный присоединению к оксосоединении алкилмагнийгалогенидов (атом алюминия участвует в поляризации связи 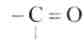 ).
).
Литийалюминийгидрид не затрагивает 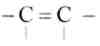 двойную связь при ее наличии в молекуле.
двойную связь при ее наличии в молекуле.
Широко применяют и восстановление водородом (в момент выделения) и водородом в присутствии катализаторов гидрирования (Pt, Pd, Ni, Си и др.)1
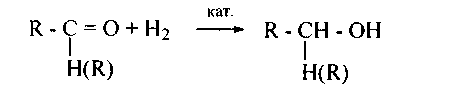
109.Напишите уравнения и назовите спирты, получающиеся при восстановлении литийалюминийгидридом (приведите механизм) и водородом в присутствии катализаторов следующих соединений:
а) изомасляный альдегид; б) пропанал-1; в) З-метилбутанал-1; г) пентанон-3; д) этил-трет-бутилкетон; е) изопропилизобутилкетон; ж) 2,3-диметилбутанал-1; з) З-метилбутанон-2.
V. Окисление альдегидовидет очень легко и в самых мягких условиях, например, при действии аммиачного раствора гидрооксида серебра (реакция серебряного зеркала) или придействии фелинговой жидкости. Обе реакции являются качественными на альдегидную группу:
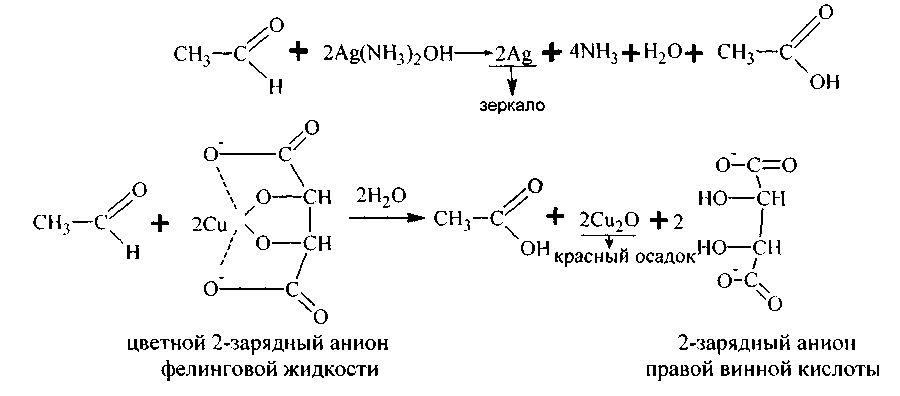
Механизм обеих реакций однотипен:
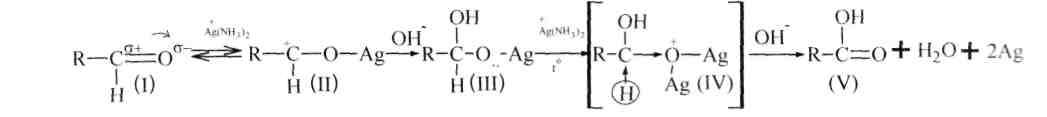
Реакция идет в несколько стадий, из них медленной является, видимо, образование промежуточного соединения или переходного состояния (IV).
Окисление кетонов протекает в более жестких условиях с разрывом углеродной цепочки и образованием двух кислот или кислоты и более простого кетона. При этом соблюдаются правила Попова А. Н.:
а) если окисляется простой кетон, то окисление идет по одному из α-углеродных атомов с образованием сначала оксикетона, затем дикетона, и далее происходит образование двух кислот:
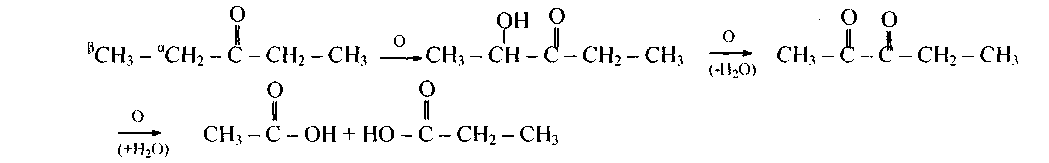
б) если окисляется смешанный кетон, то окисление идет по тому α -углеродному атому, который содержит меньшее число атомов водорода, например,
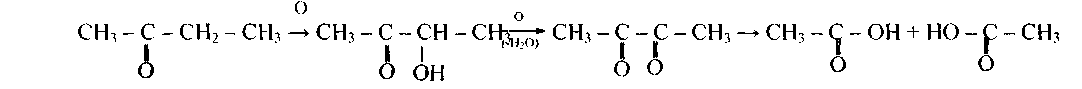
в) если подвергается окислению такой смешанный кетон, у которого α-углеродные атомы содержат одинаковое число атомов водорода, то окисляется тот а-углеродный атом, который связан с меньшим радикалом, например: 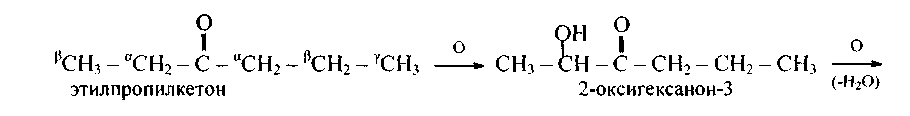
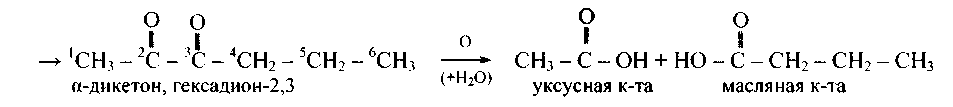
Механизм разрыва С - Н σ-связи соседнего с карбонилом углерода в щелочной среде легко объясним енолизацией кетона:

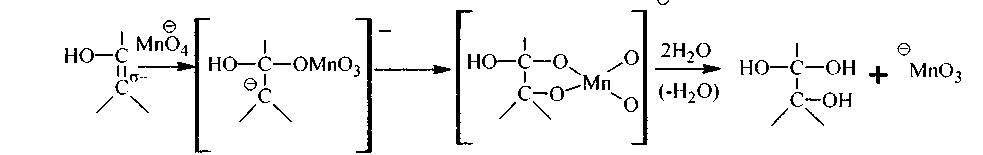
И в кислотной среде (где тоже в избытке нуклеофилы окислителя) возможен отрыв α-водородов в виде протона и образование аналогичных промежуточных структур:
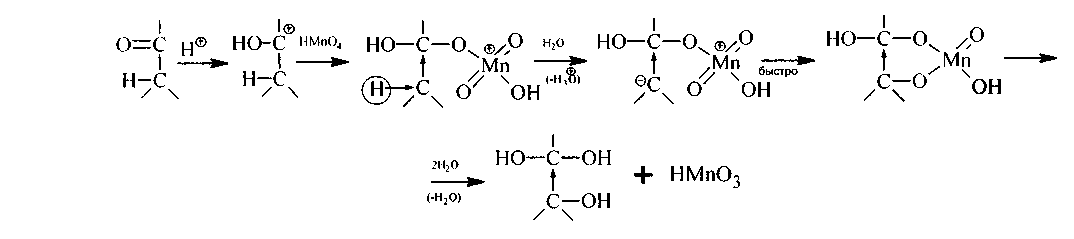
Дальнейшее окисление идет с разрывом С - С σ-связи.
Окисление образовавшихся α-дикетонов в разных средах может, видимо, идти следующим образом. В кислой среде:
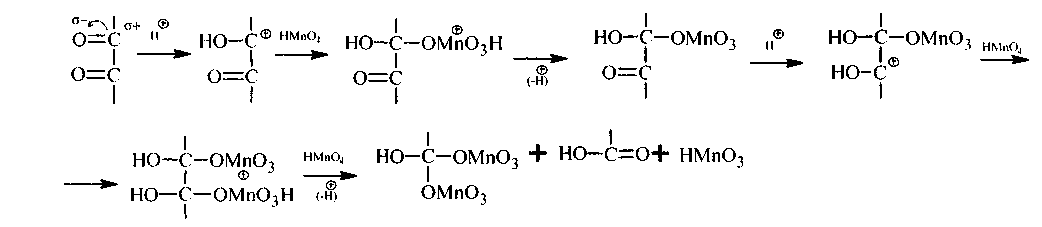
В щелочной среде процесс идет труднее (при нагревании):
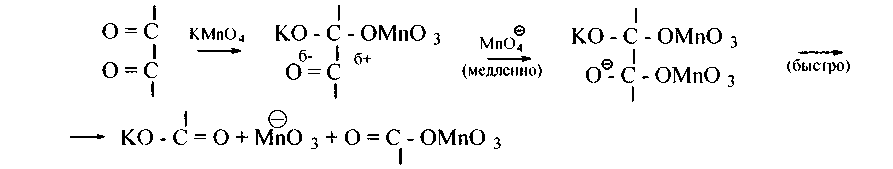
110. Напишите уравнения и механизмы реакций окисления следующих соединений: а) этаналь; б) 2-метилпропаналь-1; в) З-метилбутаналь-1; г)бензойный альдегид; д) пропилбутилкетон; е) метилизопропилкетон; ж) гексанон-3; з) октанон-3; и) этилизопропилкетон; к) а-метилмасляный альдегид.
Дата добавления: 2017-05-02; просмотров: 9665;











