Тепловые эффекты реакций. Закон Гесса
В термохимии количество теплоты Q, которая выделяется или поглощается в результате химической реакции, называется тепловым эффектом. Реакции, протекающие с выделением тепла, называются экзотермическими (Q>0), а с поглощением тепла - эндотермическими (Q<0).
В термодинамике соответственно процессы, при которых теплота выделяется, называются экзотермическими, а процессы, при которых теплота поглощается – эндотермическими.
Согласно следствию из первого закона термодинамики для изохорно-изотермических процессов тепловой эффект равен изменению внутренней энергии системы 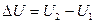 .
.
Поскольку в термохимии применяется обратный знак по отношению к термодинамике, то 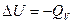 .
.
Для изобарно-изотермических процессов тепловой эффект равен изменению энтальпии системы 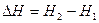 .
.
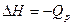 .
.
Если DH > 0 – процесс протекает с поглощением теплоты и является эндотермическим.
Если DH < 0 – процесс сопровождается выделением теплоты и является экзотермическим.
Из первого начала термодинамики вытекает закон Гесса:
тепловой эффект химических реакций зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода из исходного состояния в конечное.
Следствием из этого закона является правило, согласно которому с термохимическими уравнениями можно производить обычные алгебраические действия.
В качестве примера рассмотрим реакцию окисления угля до СО2.
Исходные вещества: кислород О2 и уголь, который считаем чистым углеродом С. Конечный продукт – углекислый газ СО2.
Переход от исходных веществ к конечному можно осуществить, непосредственно сжигая уголь до СО2:
С(т) + О2 (г) = СО2(г).
Тепловой эффект этой реакции ΔН1.
Можно провести этот процесс в две стадии (рис. 4). На первой стадии углерод сгорает до СО по реакции
С(т) + 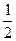 О2 (г) = СО(г),
О2 (г) = СО(г),
на второй СО догорает до СО2
СО(т) + 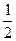 О2 (г) = СО2(г).
О2 (г) = СО2(г).
Тепловые эффекты этих реакций соответственно ΔН2 иΔН3.
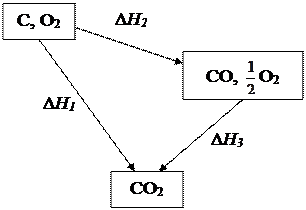
Рис. 4. Схема процесса горения угля до СО2
Все три процесса находят широкое применение в практике. Закон Гесса позволяет связать тепловые эффекты этих трех процессов уравнением:
ΔН1=ΔН2 + ΔН3.
Тепловые эффекты первого и третьего процессов можно сравнительно легко измерить, но сжигание угля до окиси углерода при высоких температурах затруднительно. Его тепловой эффект можно рассчитать:
ΔН2=ΔН1 - ΔН3.
Значения ΔН1 и ΔН2 зависят от вида применяемого угля. Величина ΔН3 с этим не связана. При сгорании одного моля СО при постоянном давлении при 298К количество теплоты составляет ΔН3=-283,395 кДж/моль. ΔН1=-393,86 кДж/моль при 298К. Тогда при 298К ΔН2=-393,86 + 283,395=-110,465кДж/моль.
Закон Гесса дает возможность вычислить тепловые эффекты процессов, для которых отсутствуют экспериментальные данные или для которых они не могут быть измерены в нужных условиях. Это относится и к химическим реакциям, и к процессам растворения, испарения, кристаллизации, адсорбции и др.
Применяя закон Гесса, следует строго соблюдать следующие условия:
- в обоих процессах должны быть действительно одинаковые начальные состояния и действительно одинаковые конечные состояния;
- должны быть одинаковыми не только химические составы продуктов, но и условия их существования (температура, давление и т.д.) и агрегатное состояние, а для кристаллических веществ и кристаллическая модификация.
При расчетах тепловых эффектов химических реакций на основе закона Гесса обычно используют два вида тепловых эффектов - теплоту сгорания и теплоту образования.
Теплотой образования называется тепловой эффект реакции образования данного соединения из простых веществ.
Теплотой сгорания называется тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов соответствующих элементов или соединения этих оксидов.
Справочные значения тепловых эффектов и других величин относят обычно к стандартному состоянию вещества.
В качестве стандартного состояния индивидуальных жидких и твердых веществ принимают состояние их при данной температуре и при давлении, равном одной атмосфере, а для индивидуальных газов – такое их состояние, когда при данной температуре и давлении, равном 1,01·105 Па (1атм.), они обладают свойствами идеального газа. Для облегчения расчетов справочные данные относят к стандартной температуре 298 К.
Если какой-нибудь элемент может существовать в нескольких модификациях, то в качестве стандартной принимают такую модификацию, которая является устойчивой при 298 К и атмосферном давлении, равном 1,01·105 Па (1атм.)
Все величины, относящиеся к стандартному состоянию веществ, отмечают верхним индексом в виде круга: 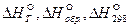 . В металлургических процессах большинство соединений образуется с выделением теплоты, поэтому для них приращение энтальпии
. В металлургических процессах большинство соединений образуется с выделением теплоты, поэтому для них приращение энтальпии 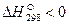 . Для элементов в стандартном состоянии величина
. Для элементов в стандартном состоянии величина 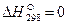 .
.
Пользуясь справочными данными стандартных теплот образования веществ, участвующих в реакции, можно легко рассчитать тепловой эффект реакции.
Из закона Гесса следует:
тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения (конечных веществ или продуктов реакции), и теплотами образования всех веществ, указанных в левой части уравнения (исходных веществ), взятых с коэффициентами, равными коэффициентам перед формулами этих веществ в уравнении реакции:
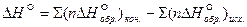 , (11)
, (11)
где n – количество молей вещества, участвующих в реакции.
Пример. Рассчитаем тепловой эффект реакции Fe3O4 + CO = 3FeO + CO2. Теплоты образования веществ, участвующих в реакции, составляют: для Fe3O4 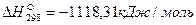 , для СО
, для СО 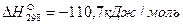 , для FeO
, для FeO 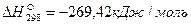 , для CO2
, для CO2 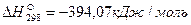 .
.
Тепловой эффект реакции
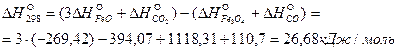
Так как 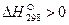 , реакция при 298К эндотермическая, т.е. идет с поглощением теплоты.
, реакция при 298К эндотермическая, т.е. идет с поглощением теплоты.
Дата добавления: 2017-05-02; просмотров: 2535;











