Уравнение Клайперона 1834г.
Техническая термодинамика. Основные понятия и определения.
Термодинамика изучает законы превращения энергии в различных процессах, происходящих в макроскопических системах, и сопровождается тепловыми эффектами (макроскопическая система- это объект, который состоит из большого числа частиц). Техническая термодинамика изучает закономерности взаимного превращения тепловой и механической энергии и свойства тел, участвующих при этом вращении.
Вместе с теорией теплообмена она является теоретическим фундаментом теплотехники.
Термодинамическая система представляет собой совокупность материальных тел, находящихся в механическом и тепловом взаимодействии друг с другом и с окружающим систему внешними телами (внешней средой).
Сведения по физике
Основные параметры: температура, давление и удельный объем.
Под температурой понимают физическую величину, характеризующую степень нагретости тела. Применяют 2 температурные шкалы: термодинамическую Т(°К) и международную практическую t (°С). Соотношение между Т и t определяется по значениям тройной точки воды:
Т= t(°С)+273,15
Тройная точка воды – состояние, при котором твердое, жидкое и газообразное фазы находятся в равновесии.
За единицу давления принимается Паскаль (Па) данная единица очень мала, поэтому используют большие величины кПа, МПа. А также внесистемные единицы измерения – техническая атмосфера и миллиметры ртутного столба. (мм.рт.ст.)
Рн =760мм.рт.ст.=101325 Па=101,325 кПа = 0,1 МПА=1кг/см
Основные параметры состояния газа связаны между собой уравнением:
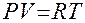
Уравнение Клайперона 1834г.
R- Удельная газовая постоянная.
Умножив левую и правую части на m, получим уравнение Менделеева, Клайперона, где m- молекулярная масса вещества:
m×R×u=R×T×m
Значение произведения m× R называют универсальной газовой постоянной, её выражение определяется из формулы:
m×R= 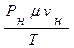
При нормальных физических условиях: 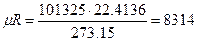 Дж/(Кмоль*К).
Дж/(Кмоль*К).
Где  m×Vн=22,4136
m×Vн=22,4136 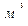 /Кмоль - молярный объем идеального газа при нормальных физических условиях.
/Кмоль - молярный объем идеального газа при нормальных физических условиях.
Удельная газовая постоянная R- это работа, затраченная на нагревание 1 кг вещества на 1 К при постоянном давлении
R= 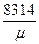 ,
,
Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным. Если между различными точками в системе существуют разности температур, давлений и других параметров, то она является неравновесной. В такой системе под действием градиентов параметров возникают потоки теплоты, вещества и другие, стремящиеся вернуть её в состояние равновесия. Опыт показывает, что изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно выйти из него не может. В классической термодинамике рассматривается только равновесные системы т.е.:
В реальных газах, в отличие от идеальных, существуют силы межмолекулярных взаимодействий (силы притяжений, когда молекулы находятся на значительном расстоянии и силы отталкивания, когда молекулы отталкиваются). И нельзя пренебречь собственным объемом молекул. Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которое называется уравнением состояния.
Опыт показывает, что удельный объем, температура и давление простейших систем, которыми являются газы, пары или жидкости связаны термическим уравнением состояния вида:
f r,u,T)=0
Уравнения состояния реальных газов.
Наличие межмолекулярных сил отталкивания приводят к тому, что молекулы могут сближаться между собой до некоторого минимального расстояния. Поэтому можно считать, что свободные для движения молекул, объем будет равен:
u-b;
где b- тот наименьший объем, до которого можно сжать газ.
В соответствии с этим длина свободного пробега уменьшается и число ударов о стенку в единицу времени, а следовательно давление увеличивается.
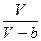 ,
, 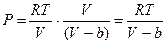 ,
,
Возникает молекулярное (внутреннее) давление.
Сила молекулярного притяжения каких-либо 2 малых частей газа пропорциональна произведению числа молекул в каждой из этих частей, т.е. квадрату плотности, поэтому молекулярное давление обратнопропорционально квадрату удельного объема газов: Рмол £ 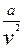
Где а - коэффициент пропорциональности, зависящий от природы газов.
Отсюда уравнение Ван-дер-Ваальса (1873г.)
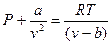
При больших удельных объемах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически выражается в уравнение состояния идеального газа Клайперона. Ибо величина 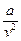 (по равнению с Р) и b по сравнению с u становятся пренебрежимо малыми.
(по равнению с Р) и b по сравнению с u становятся пренебрежимо малыми.
Дата добавления: 2021-07-22; просмотров: 537;











