Уравнение состояния
Связь между параметрами p, v, T называется термическим уравнением состояния
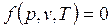
|
или
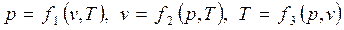 . .
|
Эти уравнения показывают, что из трех параметров, определяющих состояние системы, независимыми являются два.
Конкретный вид уравнения состояния зависит от свойств веществ.
Для идеального газа термическое уравнение состояния имеет вид:
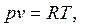
| (1.3) |
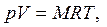
| (1.4) |
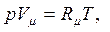
| (1.5) |
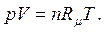
| (1.6) |
В уравнениях (1.3) – (1.6) используются следующие обозначения: p – абсолютное давление, Па; v – удельный объем, м3/кг; T – абсолютная температура, К; M – масса газа, кг; V – объем газа, м3; V 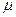 – объем 1 киломоля газа, м3/кмоль;
– объем 1 киломоля газа, м3/кмоль; 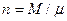 - число киломолей газа;
- число киломолей газа; 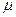 – мольная масса газа, кг/кмоль; Rm = 8314 Дж/(кмоль×К) – универсальная газовая постоянная; R =
– мольная масса газа, кг/кмоль; Rm = 8314 Дж/(кмоль×К) – универсальная газовая постоянная; R = 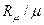 – газовая постоянная, Дж/(кг×К).
– газовая постоянная, Дж/(кг×К).
В реальных газах, в отличие от идеальных, существенны силы межмолекулярных взаимодействий, и нельзя пренебречь собственным объемом молекул. Термическое уравнение состояния реального газа можно представить в виде
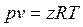 , ,
| (1.7) |
где 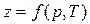 - коэффициент сжимаемости.
- коэффициент сжимаемости.
Вся сложность расчетов по уравнению (1.7) состоит в определении коэффициента сжимаемости. Реальные газы при T 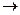 ¥ или
¥ или 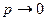 становятся идеальными, при этом z = 1.
становятся идеальными, при этом z = 1.
Понятие идеального газа является научной абстракцией, моделью реального газа, дающей хорошую сходимость с практикой. Для состояний газа, близких к состоянию сжижения (насыщенного пара) модель идеального газа неприемлема.
Дата добавления: 2021-07-22; просмотров: 457;











