СТЕПЕНЬ ДИССОЦИАЦИИ. СИЛА ЭЛЕКТРОЛИТОВ
Все электролиты подразделяются на два типа: сильные и слабые электролиты.
Сильные электролиты в водных растворах распадаются на ионы полностью, и этот процесс практически необратим
HСl ® H+ + Cl-;
Na2SO4® 2Na+ + SO4 2–.
Слабые электролиты диссоциируют на ионы частично
CH3COOH ⇄ CH3COO- + H+.
Для количественной оценки электролитической диссоциации было введено понятие степени электролитической диссоциации a.
Степень электролитической диссоциации – это отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита: a = 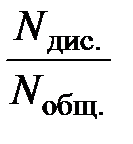 , 0 < a < 1.
, 0 < a < 1.
Степень диссоциации выражают в долях единицы или в процентах.
Для слабых электролитов a < 1. Для сильных электролитов предполагают, что a = 1.
Сильные электролиты диссоциируют практически полностью, и этот процесс практически необратим.
К сильным электролитам относят:
· многие растворимые соли (хлорид натрия NaCl, сульфат калия K2SO4, нитрат калия KNO3, хлорид цинка ZnCl2 и др.);
· многие неорганические кислоты (хлороводородная (соляная) HCl, бромоводородная HBr, йодоводородная HI, серная H2SO4, азотная HNO3, хлорная HClО4, хлорноватая HClО3, марганцовая HMnО4, хромовая H2CrО4, дихромовая H2Cr2О7);
· гидроксиды щелочных и щелочноземельных металлов (гидроксид натрия NaOH, гидроксид калия KOH, гидроксид лития LiOH, гидроксид сезия CsOH, гидроксид рубидия RbOH, гидроксид кальция Ca(OH)2, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2).
При растворении слабые электролиты диссоциируют частично и обратимо с установлением равновесия.
К слабым электролитам относятся:
· кислоты (угольная H2CO3, фосфорная Н3РО4, сероводородная H2S, уксусная CH3COOH, борная Н3ВО3, синильная НСN и др.);
· основания (гидроксид аммония NH4OH, гидроксид алюминия Al(OH)3 и др.);
В растворе слабого электролита устанавливается равновесие между недиссоциированными молекулами и диссоциированными ионами. Силами взаимодействия между ионами слабого электролита, как правило, пренебрегают.
Например, уксусная кислота в растворе диссоциирует по уравнению
CH3COOH ⇄ H+ + CH3COOH-.
На основании закона действующих масс константа диссоциации этой реакции запишется:
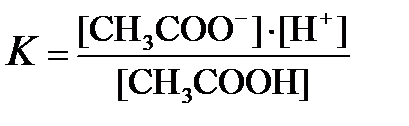
Константа равновесия К в данном случае называется константой диссоциации. Константа диссоциации представляет собой важную характеристику слабых электролитов. Чем меньше константа диссоциации, тем слабее диссоциирует электролит.
Как уже отмечалось слабые многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Первый ион Н+ или ОН- отрывается от молекулы легче, чем последующие, поэтому константа диссоциации на каждой последующей ступени на несколько порядков ниже, чем на предыдущей ступени.
Для примера рассмотрим ступенчатую диссоциацию фосфорной кислоты и гидроксида цинка.
Первая ступень H3PO4 ⇄ H+ + H2PO4- K1 = 7,53·10-3
Вторая ступень H2PO4- ⇄ H+ + HPO4 2- K2 = 6,31·10-8
Третья ступень HPO42-⇄ H+ + PO4 3- K3 = 1,26·10-12
Первая ступень Zn(ОН)2 ⇄ ZnОН+ + OH- K1 = 4,4·10-5
Вторая ступень ZnOH+ ⇄ Zn(OH)2 + OH- K2 = 1,5·10-9
Сравнивая величины констант диссоциации, видим, что первая ступень диссоциации выражена значительно сильнее, чем последующие. Поэтому в растворах таких веществ в заметных количествах имеются только те ионы, которые образуются по первой ступени диссоциации.
Константа диссоциации, как и любая константа равновесия, зависит от природы диссоциирующего вещества, от температуры, и не зависит от концентрации раствора. С повышением температуры константа диссоциации обычно уменьшается. В соответствии с принципом Ле - Шателье это означает, что процесс диссоциации является экзотермическим, т.е. теплота гидратации ионов выше энергии, затрачиваемой на разрыв внутримолекулярных связей.
Как ранее указывалось, под степенью электролитической диссоциации a понимают отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества.
На примере реакции диссоциации уксусной кислоты рассмотрим, как зависит степень диссоциации слабого электролита от его концентрации в растворе.
Пусть исходного вещества CH3COOH взято 1 моль. На ионы распалась часть моля, равная a, т.е. образовалось ионов
H+ = CH3COO- = a. Осталось не распавшихся молекул 1 – a.
Если объем раствора, в котором растворен 1 моль взятого вещества, равен V, то концентрации будут равны:
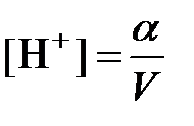 ; [CH3COO—]=
; [CH3COO—]= 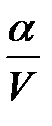 ;
;
[CH3COOH]= 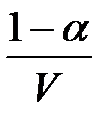 .
.
Константа диссоциации будет равна:
K = 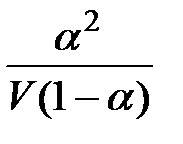 ,
,
а т. к. 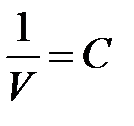 (концентрация), то
(концентрация), то
K= 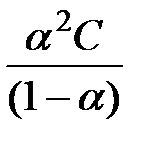 .
.
Если a << 1, то можно считать, что К » a2С, т. е.
a » 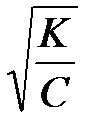 .
.
Степень диссоциации слабых электролитов зависит от температуры и от концентрации электролита. Это соотношение между константой диссоциации и степенью диссоциации электролита в 1888 г. вывел немецкий ученый Фридрих Оствальд, и называется оно законом разбавленияОствальда.
По закону разбавления Оствальда: с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается.
Дата добавления: 2019-12-09; просмотров: 1119;










