ПОНЯТИЕ О КОРРОЗИИ МЕТАЛЛОВ И КЛАССИФИКАЦИЯ
Коррозия металлов — самопроизвольное разрушение металлов вследствие химического или электрохимического взаимодействия их с внешней средой. Коррозионный процесс — гетерогенный (неоднородный), протекает на границе раздела металл — агрессивная среда, имеет сложный механизм. При этом атомы металла окисляются, т.е.J теряют валентные электроны, атомы переходят через границу раздела во внешнюю среду, взаимодействуют с ее компонентами и образуют продукты коррозии. В большинстве случаев коррозия металлов пройм ходит неравномерно по поверхности, имеются участки, на которых возникают локальные поражения. Некоторые продукты коррозии, образуя поверхностные пленки, сообщают металлу коррозионную стойкость. Иногда могут появляться рыхлые продукты коррозии, имеющие слабое сцепление с металлом. Разрушение таких пленок вызывает интенсивную коррозию обнажающегося металла. Коррозия металла снижает механическую прочность и меняет другие свойства его. Коррозионные процессы классифицируют по видам коррозионных разрушений, характеру взаимодействия металла со средой, условиям протекания.
Коррозия бывает сплошная, общая и местная. Сплошная коррозия протекает по всей поверхности металла. При местной коррозии поражения локализуются на отдельных участках поверхности.
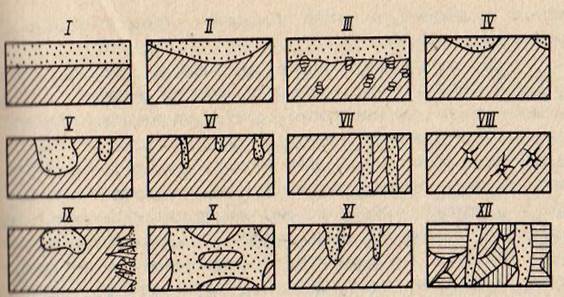
Рис. 1 Характер коррозионных разрушений:
I – равномерное; II — неравномерное; III — избирательное; IV — пятна; V — язвы; VI — точками или питтингами; VII — сквозное; VIII — нитевидное; IX — поверхностное; X — межкристаллитное; XI — ножевое; XII — растрескивание
Общая коррозия подразделяется на равномерную, неравномерную и избирательную (рис. 1).
Равномерная коррозия протекает с одинаковой скоростью по всей поверхности металла; неравномерная — на различных участках поверхности металла с неодинаковой скоростью. При избирательной коррозии разрушаются отдельные компоненты сплава.
При коррозии пятнами диаметр коррозионных поражений большой глубины. Для язвенной коррозии характерно глубокое поражение участка поверхности ограниченной площади. Как правило, язва находятся над слоем продуктов коррозии. При точечной (питтинговой) коррозии наблюдаются отдельные точечные поражения поверхности металла, которые имеют малые поперечные размеры при значительной глубине. Сквозная — это местная коррозия, вызывающая разрушение металлического изделия насквозь, в виде свищей. Нитевидная коррозия проявляется под неметаллическими покрытиями и виде нитей. Подповерхностная коррозия начинается с поверхности, пи преимущественно распространяется под поверхностью металла, вызывая его вспучивание и расслоение.
При межкристаллитной коррозии разрушение сосредоточено по границам зерен металла или сплава. Этот вид коррозии опасен тем, что происходит потеря прочности и пластичности металла. Ножевая коррозия имеет вид надреза ножом вдоль сварного соединения в сильно агрессивных средах. Коррозионное растрескивание протекает при одновременном воздействии коррозионной среды и растягивающих остаточных или приложенных механических напряжениях.
Металлические изделия в определенных условиях подвергаются коррозионно-усталостному разрушению, протекающему при одновременном воздействии на металл коррозионной среды и переменных I механических напряжений.
По характеру взаимодействия металла со средой различают химическую и электрохимическую коррозии. Химическая коррозия — разрушение металла при химическом взаимодействии с агрессивной средой, которой служат неэлектролиты - жидкости и сухие газы. Электрохимическая коррозия - разрушение металла под воздействием электролита при протекании двух самостоятельных, но взаимосвязанных процессов — анодного и катодного. Анодный процесс — окислительный, проходит с растворением металла; катодный процесс — восстановительный, обусловлен электрохимическим восстановлением компонентов среды. Современная теория коррозии металлов не исключает совместного протекания химической и электрохимической коррозии, так как в электролитах при определенных условиях возможен перенос массы металла по химическому механизму.
По условиям протекания коррозионного процесса наиболее часто встречаются следующие виды коррозии:
1) Газовая коррозия, протекает при повышенных температурах и полном отсутствии влаги на поверхности; продукт газовой коррозии — окалина обладает при определенных условиях защитными свойствами;
2) Атмосферная коррозия, протекает в воздухе; различают три вида атмосферной коррозии: во влажной атмосфере — при относительной влажности воздуха выше 40 %; в мокрой атмосфере - при относительной влажности воздуха, равной 100 %; в сухой атмосфере — при относительной влажности воздуха менее 40 %; атмосферная коррозия — один из наиболее распространенных видов вследствие того, что основная часть металлического оборудования эксплуатируется в атмосферных условиях;
3) жидкостная коррозия - коррозия металлов в жидкой среде; различают коррозию в электролитах (кислоты, щелочи, солевые растворы, морская вода) и в неэлектролитах (нефть, нефтепродукты, органические соединения);
4) подземная коррозия — коррозия металлов, вызываемая в основном действием растворов солей, содержащихся в почвах и грунтах; коррозионная агрессивность почвы и грунтов обусловлена структурой и влажностью почвы, содержанием кислорода и других химических соединений, рН, электропроводностью, наличием микроорганизмов;
5) биокоррозия — коррозия металлов в результате воздействия микроорганизмов или продуктов их жизнедеятельности, в биокоррозии участвуют аэробные и анаэробные бактерии, приводящие к локализации коррозионных поражений;
6) электрокоррозия, возникает под действием внешнего источника тока или блуждающего тока;
7) щелевая коррозия — коррозия металла в узких щелях, зазорах,
м резьбовых и фланцевых соединениях металлического оборудования,
аксплуатирующегося в электролитах, в местах неплотного контакта
металла с изоляционным материалом;
8) контактная коррозия, возникает при контакте разнородных металлов в электролите;
9) коррозия под напряжением, протекает при совместном воздействии на металл агрессивной среды и механических напряжений — постоянных растягивающих (коррозионное растрескивание) и переменных или циклических (коррозионная усталость);
10) коррозионная кавитация — разрушение металла в результате одновременно коррозионного и ударного воздействий. При этом защитные пленки на поверхности металла разрушаются, когда лопаются газовые пузырьки на поверхности раздела жидкости с твердым телом;
11) коррозионная эрозия — разрушение металла вследствие одновременного воздействия агрессивной среды и механического износа;
12) фреттинг-коррозия — локальное коррозионное разрушение металлов при воздействии агрессивной среды в условиях колебательного перемещения двух трущихся поверхностей относительно друг друга;
13) коррозия, обусловлена структурной неоднородностью сплава; при этом происходит ускоренный процесс коррозионного разрушения вследствие повышенной активности какого-либо компонента сплава;
14) термоконтактная коррозия, возникает за счет температурного градиента, обусловленного неравномерным нагреванием поверхности металла.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Наиболее часто встречающиеся коррозионные разрушения оборудования нефтяной промышленности вызываются электрохимической коррозией. Механизм и закономерности электрохимической коррозии необходимо знать для целенаправленной разработки и применения противокоррозионной защиты.
Электродный потенциал и термодинамическая возможность коррозии
Основная причина коррозии металлов — их термодинамическая неустойчивость в обычных условиях. Металлы (за исключением благородных) в естественных условиях находятся в виде окислов, т.е. в земной коре металлы входят в состав химических соединений (руд).
Возможность протекания процесса коррозии и стремление металла, к самопроизвольному окислению зависит от степени его термодинамической неустойчивости в конкретных условиях, т.е. от величины изменения термодинамического (изобарно-изотермического) потенциала AG данного процесса. Эта величина - мера превращения потенциальной химической энергии в полезную работу данного химического | процесса (например, в гальванических источниках тока — в электрическую работу). Знак А свидетельствует о том, что от величины G в 1 конечном (окисленном) состоянии отнимается значение ее в начальном состоянии. Если при протекании химической или электрохимической реакции термодинамический потенциал возрастает AG>0, то самопроизвольный процесс невозможен, а если убывает AG < 0, то самопроизвольный процесс возможен.
При неизменности термодинамического потенциала (AG = 0) система находится в равновесии. Это означает, что в процессе самопроизвольного окисления металла (коррозии) скорости реакций окисления и восстановления металла равны. Какое число атомов металла за единицу времени окислилось (потеряло валентные электроны и перешло в виде положительно заряженных катионов в электролит), такое же число ионов металла восстановилось из электролита в кристаллическую решетку металла, получив недостающие электроны от электрода (металла).
Окисление металла в электролитах называют анодной реакцией ионизации металла, а обратную - катодной реакцией восстановления. Обозначая соответственно их скорости, т.е. скорости потока переноса массы ионов через единицу площади граничной поверхности в единицу времени, iа и iк, получаем в равновесном состоянии iа = iк и отсутствие коррозии (некомпенсированного переноса массы металла в среду). Важно, что в процессах переноса массы и электрических зарядов через границу раздела металл - электролит при равновесном (обратимом) состоянии происходит полный баланс переноса как по массе, так и по зарядам.
Следовательно, при этом не изменяются масса электрода и его заряд. Нарушение равновесия в каком-либо одном из двух направлений приведет к окислению или, наоборот, восстановлению металла.
При анализе электрохимических процессов на электроде, погруженном в электролит, величина термодинамического потенциала характеризуется однозначно связанной с ней величиной скачка равновесного (обратимого) электрического потенциала на границе металл - электролит Δφо = ΔG/zF
где z - валентность иона металла; F - число Фарадея.
Это выражение получено из условия равенства работы, произведенной химическими силами (-ΔG) в реакции окисления одного моля металла, работе, производимой электрическими силами при восстановлении одного моля металла (ΔφоzF).
Повышение потенциала электрода выше равновесного (обратимого) приведет к сдвигу равновесия в сторону анодной реакции окисления, снижение потенциала ниже равновесного сдвинет в сторону катодной реакции восстановления.
Появление электрических сил и скачка электродного потенциала границе металл — электролит вызвано переносом зарядов (катионов) из металла в прилегающую область электролита, которая совместно с оставшимися в электроде избыточными электронами образует обкладки двойного электрического слоя, внутри которого действует электрическое поле, направленное из электролита в электрод и стремящееся возвратить катионы металла из электролита в электрод. По мере накопления катионов в электролите устанавливается динамическое равновесие, характеризуемое величиной плотности тока обмена катионами: iо = iа = iк. Для большинства металлов, погруженных в водные растворы, эта величина находится в пределах от 10-8 до 10-5 А/см2.
Если бы при погружении идеального металлического электрода электролит на границе раздела всегда протекал только процесс ионизации — восстановления данного металла, то всегда достигалось бы равновесное (обратимое) состояние, достаточное для сформирования двойного электрического слоя. Однако в большинстве случаев на поверхности реальных электродов одновременно протекают процессы с участием посторонних ионов, что препятствует установлению равновесного состояния и вызывает некомпенсированный перенос массы металла из электрода в электролит, т.е. коррозию. При этом потенциал электрода будет уже неравновесным (необратимым), и что величина будет зависеть не только от обмена электрода с электролитом собственными ионами металла, но и от реакций с участием ионов металла но и от реакций с участием ионов других веществ. При неравновесном состоянии может быть достигнут баланс между электродом и электролитом в обмене электрическими зарядами, но будет нарушен баланс по массе, так как часть восстанавливающихся ионов металла может быть заменена другими ионами и анодный процесс ионизации металла станет превалировать над катодным. Соответствующее значение устанавливающегося необратимого (неравновесного) потенциала называется стационарным потенциалом или потенциалом коррозии металла.
Рассмотрим простейший пример растворения металла в водном растворе кислоты, предполагая, что в процессе участвуют два вида ионов электролита — металла и водорода по реакциям
катодной
Ме ⇄ Меz+ + Н2О + zе,
анодной
Надс ⇄ Н+Н2О + ,е,
где Me - атом металла в твердом электроде; е — электрон (в элек- 1 троде); Надс — атом водорода, адсорбированный на электроде; Mez+ —ион металла в электролите; Н+ — ион водорода в электролите. (Стрелка, направленная слева направо, означает анодную реакцию, а наоборот — катодную).
Обозначим скорости анодной iMe а и iMe к и катодной iНа и iНк реакций. При отсутствии в электролите ионов водорода протекает только обратимая катодная реакция, и устанавливается равновесие iMe а = iMe к = i0 при отсутствии потери массы металла, а электрод приобретает равновесный (обратимый) потенциал, который зависит от концентрации катионов металла в электролите по уравнению Нернста
φ = φ0 +
где R — газовая постоянная; T — абсолютная температура; — активность ионов металла в электролите; φ0 — стандартный электродный потенциал (обратимый потенциал при = 1).
Если одновременно протекают катодная и анодная реакции, то равновесие по ионам металла нарушается и устанавливается неравновесный стационарный потенциал электрода, устойчивый во времени, значение которого определяют из условия равенства сумм скоростей анодных и катодных реакций (балансовое уравнение)
iMe а + iНа = iMe к + iНк
Это условие означает, что при стационарном потенциале достигнут баланс зарядов, т.е. в стационарном состоянии не происходит накопления зарядов в электроде и в электролите, но в то же время может быть нарушен баланс по массе металла.
Из уравнения сумм скоростей реакций видно, что если iНа < iНк, то имеем iMe а > iMe к и преобладает анодная реакция окисления металла. Следовательно, потеря массы электрода будет происходить в том случае, если анодный процесс реализуется ионами металла, а катодный — ионами водорода или другими ионами и молекулами раствора, которые в таком случае принято называть деполяризаторами. Чем больше разница величин в неравенстве iНа > iНк, тем выше скорость коррозии iкор = iMe а - iMe к. Иными словами, чем выше способность деполяризатора присоединять электроны из электрода, т.е. катодно восстанавливаться, тем интенсивнее коррозия.
Термодинамическая эффективность деполяризатора характеризуется величиной равновесного (обратимого) потенциала соответствующий электрохимической реакции окисления — восстановления деполяризатора. Чем более положителен этот потенциал, тем выше способность деполяризатора отбирать электроны у электрода, осуществляя катодную реакцию в коррозионном процессе и вытесняя из нее катионы металла.
Балансовое уравнение показывает, что потеря массы электрода происходит в том случае, если установившийся неравновесный стационарный потенциал φстац будет ниже равновесного (обратимого) потенциала φHo окислительно-восстановительной реакции деполяризации, чтобы существовало неравенство iНк > iНа, т.е. равновесие этой
реакции было сдвинуто в сторону катодного восстановления деполяризатора. Значение φстац должно быть выше равновесного (обрати
мого) потенциала металла φМео, чтобы соблюдалось неравенство iMe а > iMe к.
Поскольку установившийся стационарный потенциал электрода вследствие поляризации принимает значение, промежуточное между φМео и φHo, следует, что условие развития процесса коррозии — неравенство φМео < φHo, а мерой движущей силы процесса служит разность Δφкор = φHo - φМео. Действительно, в такой неравновесной системе, состоящей из двух подсистем, соответствующих реакциям, и 1монение термодинамического потенциала ΔG складывается из двух частей:
ΔG = ΔG1 + ΔG2 = -zF(ΔφМео - ΔφHo) = - zFΔφкор
Поскольку термодинамическим условием самопроизвольного протекания процесса служит неравенство ΔG < 0, получаем Δφкор > 0, т.е. должно быть φHo > φМео.
Условие термодинамической возможности электрохимической коррозии - это присутствие в электролите вещества-деполяризатора, равновесный окислительно-восстановительный потенциал которого более положителен, чем у корродирующего металла.
Фактические скорости электрохимических реакций зависят от кинематических условий их протекания. Важный фактор — физическая и физико-химическая неоднородность границы раздела металл — электролит и прилегающих областей, приводящая к неоднородному (гетерогенному) распределению на поверхности металла анодных и катодных реакций с образованием областей преимущественного развития анодной или катодной реакции. Эти области могут быть разделеными в течение коррозионного процесса перемещаться на поверхности металла, хотя в принципе возможно и совмещение этих реакций на одной площади.
Разделение катодных и анодных процессов с четко выраженными анодами и катодами позволяет определить скорость коррозии с помощью модели коррозионного гальванического элемента (катод—анод). Но при совмещении этих реакций (гомогенный механизм коррозии) такая модель недостаточна и необходимо использовать уравнения электрохимической кинетики.
На практике встречается гетерогенная электрохимическая коррозия технических сплавов, поэтому рассмотрим подробнее модель коррозионного гальванического элемента.
Коррозионный гальванический элемент
При электрохимической коррозии протекают два, процесса — катодный и анодный, которые образуются на различных участках металлической поверхности. При этом катодные и анодные участки пространственно разделены (локализованы). Локализация анодных и катодных участков вызывается неоднородностью: присутствием в металле незначительных примесей, структурных составляющих сплавов; неравномерным распределением собственных ионов металла, ионов водорода, кислорода и др. возле корродирующей поверхности; неравномерным нагревом различных участков поверхности и наложением внешнего электрического поля; неоднородностью поверхности металла, обусловленной дефектами защитных пленок, продуктов коррозии неравномерной деформацией, неравномерностью приложенных внешних нагрузок.
В общем случае локализация процессов происходит на участках отличающихся физическими и химическими свойствами.
Модель коррозионного элемента показана на рис2. Выделяют три основные стадии коррозионного процесса.
1. Анодный процесс — переход ионов металла в раствор и гидратация с образованием некомпенсированных электронов на анодных участках по реакции
Ме + nН2О → Меz+ + nН2О + ze.
2. Процесс электропереноса — перетекание электронов по металлу от анодных участков к катодным и соответствующее перемещение катионов в растворе.
3. Катодный процесс — ассимиляция электронов каким-либо деполяризатором — ионами и молекулами, находящимися в растворе и способными восстанавливаться на катодных участках по реакции
D + z → [D z].
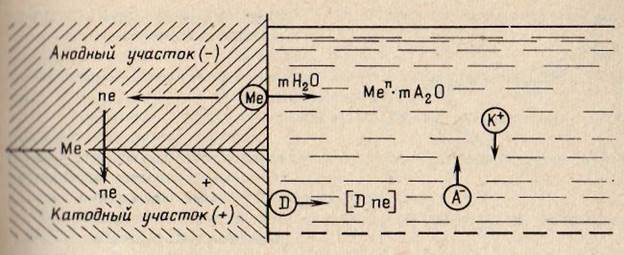
Рис. 2. Схема электрохимического коррозионного процесса
Если процесс деполяризации происходит за счет восстановления кислорода, то коррозионный процесс идет с кислородной деполяризацией
О2 + 2Н2О + 4 → 4ОН-.
Если деполяризатором служат ионы водорода, то процесс идет с водородной деполяризацией
Н+ + → Н,
Н + Н → Н2 → Н2↑.
Особенности электрохимического процесса коррозии следующие:
одновременное протекание катодного и анодного процессов;
зависимость скорости коррозии, обусловленной механизмом электрохимических процессов, от электродного потенциала металла;
3) возможность локализации электродных процессов на различных участках поверхности корродирующего металла, где их протекание облегчено;
4) реализация материального эффекта коррозии (растворение металла) на анодных участках при локализации электродных процессов.
Контролирующий фактор электрохимической коррозии, определяющий ее скорость, — поляризация электрода — изменение разности потенциалов коррозионного элемента, приводящее к уменьшению силы тока. Поляризация тормозит скорость протекания электрохимической коррозии металлов. Основная причина поляризации — отставание электродных процессов (катодного и анодного) от перетока электронов в металле. Так, если анодный процесс отстает от перетока электронов от анода к катоду, то происходит уменьшение отрицательного заряда на поверхности электрода. Потенциал анода при этом становится положительнее. Катодный процесс отстает от поступления электронов на катод, происходит увеличение отрицательного заряда на поверхности электрода, что приводит соответственно к сдвигу потенциала катода в отрицательную сторону.
При графическом изображении зависимости потенциала электрода от плотности тока с помощью поляризационных кривых наглядно видно, что при катодной поляризации происходит рост потенциала, а при анодной — его снижение (рис. 3). Чем круче поляризационная кривая, тем больше величина поляризационного сопротивления и тем труднее протекает коррозионный процесс. При пологих поляризационных кривых происходит малая поляризация и легче протекает коррозионный процесс. Скорость коррозии уменьшается как вследствие поляризации анода, так и катода.
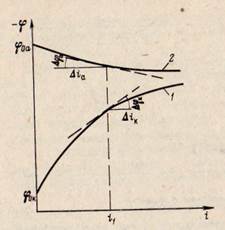
Рис. 3. Поляризационные кривые:
/ —анодная; 2 — катодная
В общем случае скорость электрохимического коррозионного процесса можно выразить следующим соотношением:
где / — сила коррозионного тока; φко – φао — разность начальных потенциалов катода и анода, являющаяся движущей силой коррозионного процесса, характеризует термодинамическую возможность протекания электрохимической коррозии; R - омическое сопротивлении коррозионного элемента; Рк, Ра- поляризационное сопротивления катодного и анодного процессов соответственно (сопротивление протеканию электродных процессов). Оно имеет смысл для линейной! поляризации (линейной зависимости тока от потенциала).
При нелинейной зависимости тока от потенциала используют понятие поляризуемости
Р'к = Δφк/Δiк; Р'а = Δφа/Δiа.
Эти величины — отношение величины смещения потенциала к плотности или приращению плотности тока. Омическое сопротивление учитывает сопротивление электролита.
Снизить скорость коррозии можно при:
1)уменьшении степени термодинамической нестабильности — сближении потенциалов катодного и анодного процессов;
2) увеличении катодной поляризуемости Р, приводящем к торможению катодного процесса;
3) увеличении анодной поляризуемости Р, приводящем к торможению анодного процесса;
4) увеличении омического сопротивления R.
Торможение коррозионного процесса по одному из указанных Путей определяет вид контроля.
Различают коррозию, протекающую с катодным, анодным или омическим контролем. В практике нефтяной промышленности встречаются в основном процессы с катодным контролем.
Электродные процессы, уменьшающие поляризацию на аноде и Катоде, называются процессами деполяризации, а вещества, препятствующие поляризации, — деполяризаторами. На практике встречаются и в основном процессы коррозии с кислородной и водородной деполяризацией.
При коррозии с водородной деполяризацией на катоде протекает реакция разряда ионов гидроксония по схеме
2Н3О+ +2→ 2Н2О + Н + Н → 2Н2О + Н2↑.
Катодный процесс водородной деполяризации состоит из: диффузии ионов гидроксония к катоду с последующим их разрядом и образованием водородных атомов, адсорбирующихся на металле; молязации водородных атомов с образованием молекулярного водорода, который, в свою очередь, диффундирует и переносится конвекцией от катодных участков в раствор. Часть адсорбированных атомом водорода диффундирует в металл, вызывая явление водородного охрупчивания.
Процессы водородной деполяризации характерны в основном для технологических процессов, протекающих в кислых средах.
Коррозия с кислородной деполяризацией — наиболее распространенный процесс, так как по этому механизму корродируют металлы в водных средах, влажной атмосфере, почве. Катодный процесс кислородной деполяризации заключается в ионизации кислорода на катоде. Причем в зависимости от рН среды будут различными конечные продукты ионизации. При рН > 7 ионизация кислорода на катоде протекши по схеме
О2 + 4 + 2Н2О → 4ОН-,
при рН < 7 — по схеме
О2 + 4 + 4Н+ → 2Н2О.
Катодный процесс коррозии с кислородной деполяризацией имеет последовательные стадии: прохождение кислорода через поверхность раздела воздух—электролит; перенос растворенного молекулярного кислорода в объеме электролита при механическом перемешивании, конвекции и диффузии к катодным участкам поверхности; перенос кислорода в диффузионном слое; ионизация кислорода; диффузия и конвективный перенос ионов ОН= от катодных участков поверхности металла в электролит.
Коррозия зависит от нескольких факторов. Скорость электрохимической коррозии металлов существенно зависит от температуры, с ее повышением скорость растет. При нейтральных значениях рН для процесса коррозии с кислородной деполяризацией зависимость скорости коррозии от температуры носит сложный характер. Это связано с тем, что с повышением температуры уменьшается растворимость кислорода. В открытых аэрируемых системах скорость коррозии железа с ростом температуры в пределах от 293 до 353 К возрастает и далее уменьшается вследствие резкого снижения концентрации кислорода. В закрытой системе, когда кислород не может выделяться из раствора скорость коррозии железа непрерывно растет с повышением температуры.
В минерализованных средах скорость коррозии стали растет с увеличением скорости движения среды из-за усиления подачи кислорода к металлической поверхности. В пресной воде при скорости движения среды до 0,4 м/с скорость коррозии стали заметно возрастает вследствие облегчения диффузии кислорода к металлической поверхности. С ростом скорости движения насыщенной кислородом среды до 0,8—0,9 м/с скорость коррозии снижается в результате образования пассивной пленки на металле при достаточно обильном noступлении кислорода. При дальнейшем увеличении скорости движения среды происходит разрушение защитной пленки и самого металла в результате коррозионно-эрозионных и кавитационных процессов. Скорость коррозии при этом растет.
Давление в значительной степени ускоряет электрохимическую коррозию металлов из-за повышения растворимости деполяризаторов коррозионного процесса (кислород, сероводород и др.) и появления механических напряжений в металле.
Поляризация корродирующего металла внешним постоянным током влияет на коррозионное разрушение металлов: при анодном поляризации металла (подключении его к положительному полюсу внешнего источника тока) скорость коррозии увеличивается, при катодной поляризации в большинстве случаев наблюдается защитный эффект, т.е. скорость коррозии металла уменьшается.
Скорость коррозии зависит от рН среды, возрастая по мере подкисления среды, если не происходит пассивирования металла. В нейтральных средах скорость коррозии железа слабо зависит от изменения величины рН. При возрастании рН скорость коррозии железа и стали уменьшается.
Наличие в среде микроорганизмов и продуктов их жизнедеятельности оказывает существенное влияние на характер коррозионных разрушений металлов. При микробиологической коррозии коррозионные поражения носят локальный характер, скорость коррозии достигает значительных величин.
Внутренняя электрохимическая коррозия металлов связана с природой металла, его составом, структурой, состоянием поверхности, напряжениями в металле, а также с термодинамической устойчивостью металла и его местом в периодической системе элементов. Так, металл, нестойкий в одних условиях, в других условиях оказывается стойким. Это обусловлено тем, что протекание термодинамически возможного процесса бывает заторможено образующимися пассивными пленками, труднорастворимыми продуктами коррозии.
Термодинамическая устойчивость выше у металлов с более положительным равновесным потенциалом. Для оценки коррозионного процесса необходимо знать кинетику катодного и анодного процессов. Скорость и характер коррозии металлов в электролитах зависят структуры, состояния исходной поверхности металла, различных и воздействия механического фактора.
Тщательно отполированная поверхность металла придает ему коррозионную устойчивость в агрессивных средах, так как облегчается образование более совершенных и однородных защитных пленок, в том числе не и пассивных.
На процесс коррозии металлов оказывают влияние кристаллическая структура металлов и наличие различных структурных дефектов. Установлено, что скорость коррозии увеличивается при низкой плотности упаковки атомов и кристаллографической плоскости, неупорядоченности атомов кристаллической решетки, дефектах ее структуры. Структурная гетерогенность сплава во многом предопределяет развитие электрохимической коррозии. В отличие от однородных сплавов гетерогенной структуры менее стойки к коррозии. Скорость коррозии уменьшается, если анодная фаза гетерогенной структуры способна пассивироваться. После растворения анодной фазы в поверхностном слое сплав приобретает практически однофазную структуру. Если заметно коррозирует и катодный компонент сплава, то возможно вторичное (контактное, т.е. без тока внешней поляризации) выделение благородного компонента на поверхности сплава в виде несплошного пористого покрытия. Коррозия при этом усиливается. Величина зерна в некоторой степени влияет на скорость коррозии. При утолщении и загрязнении границ его примесями увеличивается микроэлектрохимическая гетерогенность и может начаться процесс межкристаллитной коррозии.
Значительное число металлических изделий эксплуатируется в условиях одновременного воздействия коррозионной среды и механических напряжений. Опасность коррозионно-механического воздействия заключается в том, что при значительной скорости общей коррозии происходит полное разрушение металлического изделия. Под влиянием коррозионной среды и деформации металла возможны образование коррозионно-механических трещин, понижение предела коррозионной усталости, разрушение металла вследствие механического воздействия агрессивной среды, коррозионная кавитация и другие процессы.
ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА КОРРОЗИЮ ВНУТРЕННЕЙ ПОВЕРХНОСТИ ТРУБОПРОВОДА НЕФТЯНОГО ГАЗА
При транспорте неподготовленного сероводородсодержащего нефтяного газа внутренняя поверхность газопроводов подвергается интенсивному коррозионному разрушению. В основном коррозионные поражения протекают по нижней образующей трубопроводов, причем скорость коррозии достигает 2—3 мм/год.
Коррозионную активность транспортируемому газу придает жидкий конденсат, появление которого в газопроводе сырого нефтяного газа обусловлено двумя причинами: выносом жидкости (нефть и вода) из сепарационных узлов и конденсацией углеводородов газа и водяных паров. Конденсация происходит при снижении температуры газа по трассе газопровода до температуры грунта.
Различные формы разрушения газопроводов, вызываемые содержащимися в газе сероводородом и двуокисью углерода в присутствии влаги, можно разделить на следующие виды.
Общая коррозия — электрохимическое растворение металла с поверхности, контактирующей с электролитом, проявляющееся в виде каверн, свищей, уменьшения толщины стенок труб с образованием черных продуктов коррозии, отлагающихся на корродирующей поверхности (при достаточно высоких значениях рН электролита) либо растворяющихся в электролите (при низких значениях рН). Все углеродистые и низколегированные трубные стали подвергаются этому виду разрушения при отсутствии защиты. Общую коррозию может вызывать в присутствии влаги как сероводород, так и двуокись углерода.
Сероводородное коррозионное растрескивание под напряжением (СКРН) обусловлено проникновением в присутствии H2S в металл атомарного водорода, выделяющегося на поверхности металла и процессе сероводородной общей коррозии, и вызывающее снижение пластических свойств стали, зарождение и быстрое развитие отдельных трещин, располагающихся в плоскости, перпендикулярной к направлению действующих растягивающих напряжений и приводящих к быстрому разрушению труб, работающих под давлением.
Этот вид разрушения более характерен для упрочненных малопластичных сталей и практически не поддается контролю в рабочих условиях трубопроводов, имеющих значительную протяженность. В связи с этим растрескивание под напряжением — наиболее опасный вид разрушения, который происходил даже на газопроводах, построенных из труб, обладавших высокими пластическими свойствами в исходном состоянии.
Трубы из разных сталей, в зависимости от химического состава стали, технологии изготовления труб и технологии сварочно-монтажных работ при строительстве объекта, имеют различную стойкость к сероводородному растрескиванию под напряжением.
В последние годы выделяют вызываемое сероводородом разрушение, возникающее в объеме ненапряженного металла в виде большого количества мелких трещин, расположенных, как правило, в плоскостях, параллельных плоскости листа, из которого изготовлена сварная труба, или параллельных цилиндрической поверхности бесшовной трубы. Ряд таких мелких трещин, соединяясь, может образовывать «ступеньки» или «лестницы». Ступеньки, располагаясь на различном расстоянии от поверхности трубы, могут образовать поперечную трещину, ослабляющую сечение трубы, ее конструктивную прочность. Возникновение таких трещин в ненапряженном металле связывают с наличием в нем раскатанных в процессе изготовления труб несплошностей (сульфидные и другие неметаллические включения, газовые поры и т.д.). Атомарный водород, выделяющийся в процессе общей электрохими-ческой коррозии, рекомбинирует в молекулярный и накапливается в несплошностях, имеющих вытянутую форму, развивает значительное местное давление и вызывает зарождение трещин в вершинах несплошностей. Распространение (рост) трещин может происходить по твердым сегрегациям в металле и соседним несплошностям.
В соответствии с причиной, вызывающей этот вид разрушения,
оно получило наименование ВИР (водородом индуцированное растрескивание), часто этот вид разрушения сопровождается образованием вздутий на внутренней, контактирующей с сероводородсодержащей средой, поверхности труб. Вздутия вызываются давлением молекулярного водорода, скопившегося в подповерхностном слое металла.
Для оценки стойкости к сероводородному растрескиванию труб используют наиболее распространенные методы, предлагаемые национальной ассоциацией инженеров-коррозионистов США (NACE): методика ТМ-01-77 по определению порогового напряжения
| <== предыдущая лекция | | | следующая лекция ==> |
| Методы очистки производственных сточных вод. | | | Гидравлические прессы |
Дата добавления: 2017-04-05; просмотров: 3929;











