Получение здорового посадочного материала ягодных культур
Плодовые и ягодные культуры, размножаемые вегетативно, в сильной степени поражаются вирусами и микоплазменными заболеваниями. На яблоне выявлено 19 вирусов и микоплазм, на косточковых культурах — более 30, землянике — 27, малине — 25, смородине — 14, крыжовнике — 9 и т. д. Вредоносность этих заболеваний может быть значительной: израстание на малине и реверсия на смородине могут вызвать полное бесплодие насаждений. Потери урожая малины в результате заражения мозаикой могут достигать 50 %, вишни от вируса некротической кольце вой пятнистости — 90, сливы от вируса шарки — 70...80, земляники от вирусов морщинистости и крапчатости — 40 %. Заражение клоновых подвоев яблони одним вирусом хлоротической пятнистости листьев яблони снижает приживаемость зеленых черенков на 10...15 %, а заражение комплексом вирусов (ХПЛЯ + бороздчатость древесины яблони) — на 20 %. Единственный эффективный способ снижения вредоносности вирусных и микоплазменных заболеваний — использование высококачественного посадочного материала.
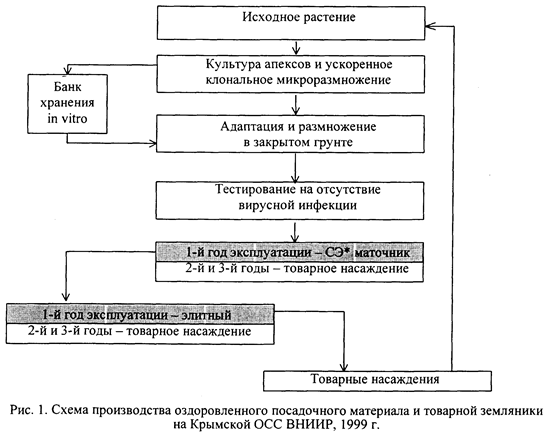
Разработана современная технология получения безвирусного посадочного материала основных плодовых и ягодных культур (яблони, груши, сливы, вишни, земляники, малины, ежевики, смородины и крыжовника). Эта технология включает следующие этапы:
отбор исходных внешне здоровых растений в полевых условиях;
предварительное тестирование отобранных растений на наличие наиболее распространенных и вредоносных вирусов методом иммуноферментного анализа (ИФА) с применением поли- и моноклональных сывороток;
основное тестирование выделенных по результатам ИФА растений на древесных и травянистых индикаторах и их повторная проверка методом ИФА;
оздоровление в случае необходимости полностью зараженных сортов от вирусов, микоплазм и других трудно искореняемых вредителей и болезней методами водной и суховоздушной термотерапии, культуры апикальных меристем, хемотерапии в пробирке и в грунте;
повторное тестирование полученных в результате оздоровления клонов;
закладка суперсуперэлитных (ССЭ) маточников и проведение комплекса мероприятий, предотвращающих перезаражение оздоровленных клонов.
Микроклональное размножение растений — надежный способ получения идентичного потомства, используемый для размножения ценных мутантов, гибридов, перспективных сортов и подвоев. Этот способ имеет большое значение при размножении оздоровленного посадочного материала плодовых, ягодных и декоративных растений. Основные достоинства: высокий коэффициент размножения; возможность работы в лабораторных условиях круглый год; размножение оздоровленных растений без контакта с внешней средой, что исключает вероятность перезаражения; возможность длительного хранения пробирочных растений, создания банка генотипов. Микроклональное размножение растений требует специальных условий, которые могут быть созданы в лабораториях. Такие лаборатории успешно работают во многих институтах: БелНИИ Плодоводства (РБ), БГСХА (РБ),
Всероссийском селекционно-технологическом институте садоводства и питомниководства (Россия), Всероссийском НИИ селекции плодовых культур (Россия), Всероссийском НИИ садоводства им. И. В. Мичурина (Россия), Всероссийском НИИ генетики и селекции плодовых растений им. И. В. Мичурина (Россия), Мичуринском государственном аграрном университете (Россия) и др.
Из оздоровленного растения ценного клона вычленяют эксплантат (трансплантат). В качестве источника эксплантатов при культивировании в стерильных условиях используют вегетативные и генеративные органы супер-суперэлитных тестированных растений. В зависимости от поставленных целей это могут быть почка, апикальная часть стебля, корня, цветка или другого органа, из которых получают каллусные ткани с последующей индукцией из них адвентивных побегов. Обычно при микроклональном размножении используют боковые и верхушечные почки, а также оздоровленные меристематические растущие верхушки почек. Желательно брать апикальные почки весной, в период начала активного роста побегов. Меристематическая верхушка состоит из собственно меристемы и двух-трех примордиальных листочков.
Почки можно брать с растений как из открытого грунта, так и из теплицы. После отделения от исходного растения почки необходимо промыть проточной водой в течение 1...2 ч и сполоснуть дистиллированной водой. Для освобождения от сапрофитной микрофлоры материал стерилизуют. Для этого обычно используют растворы диацида (0,1 %), сулемы (0,1 %), спирта (70 %), гипохлорита натрия или кальция, йода (0,01 %), нитрата ртути (0,2 %). Применяют простую стерилизацию (один стерилизующий агент) или ступенчатую стерилизацию (несколько стерилизующих агентов).
Работу ведут в боксах с установленными ламинарами, что обеспечивает высокую стерильность. Меристематическую верхушку вычленяют под бинокуляром при 30... 40-кратном увеличении специальными инструментами, которые предварительно стерилизуют в течение 1,5...2 ч при температуре 120 "С. При работе после каждой операции инструмент стерилизуют (обжигают на спиртовке). Посуду (колбы, чашки Петри) автоклавируют, фольговые пробки обжигают. Эксплантаты помещают на поверхность агаризованной среды без заглубления.
Существует много питательных сред, различающихся в основном по минеральному составу. Наибольшее распространение получила среда по рецепту Мурасиге-Скуга с высоким содержанием азота (аммония) и калия. В Мичуринском государственном аграрном университете (МГАУ) для микроклонального размножения клоновых подвоев яблони используют среды Мурасиге-Скуга и Кворина-Лапорье. Минеральный состав сред дополняют сахарозой, агар-агаром, тиамином, никотиновой кислотой, пиридоксином, мезоинозитом, рибофлавином, глютатионом, аденином, вводят физиологически активные вещества цитокининовой и ауксиновой природы. Чаще всего применяют 6-бензиламинопурин (6-БАП). Иногда используют цитокинин в сочетании с ауксинами (ИМК, ИУК) в соотношении 3:1. На стадии укоренения цитокини-ны исключают.
Регенерация эксплантата происходит в три этапа: размножение (пролиферация), рост побегов (удлинение) и укоренение.
Меристематические верхушки, взятые в качестве источника эксплантатов, при культивировании на искусственных питательных средах через 2 нед после введения в культуру начинают развиваться. Вначале растут примордиальные листья. За 4 нед культивирования они могут достигать длины 0,3...0,5 см и ширины 0,2...0,4 см. Через 4...5 нед. эксплантат переносят на свежую питательную среду (осуществляют пассаж). Пересадки проводят в стерильных условиях. При пересадке эксплантатов после первых двух-трех пассажей культивирования срез обновляют, удаляют раневой каллус. Начиная со второго пассажа, эксплантаты формируют дополнительные почки, т. е. наблюдается процесс пролиферации. При пересадке почки разделяют. За время одного пассажа при микроклональном размножении вишни от одного растения получают 5...10 побегов, пригодных к укоренению. Всего можно делать 5...6 пассажей; при этом коэффициент размножения достигает 625... 10 000, выход пробирочных растений — 600...8000 за год.
Присутствие в питательной среде 6-БАП, применяемого для пролиферации пазушных почек и побегов, препятствует процессам ризогенеза. Для получения растений с корневой системой вводят специальную фазу культивирования, в ходе которой осуществляется индукция корнеобразования у размноженных побегов. Для хорошего укоренения длина побегов яблони и груши должна быть не менее 2 см. Для этого побеги пересаживают на среды с пониженным содержанием 6-БАП и культивируют в течение 3...5 нед. Наибольшую эффективность в индукции ризогенеза обеспечивает использование риндолилмасляной кислоты (ИМК), которой можно обрабатывать непосредственно побеги, но чаще ее вводят в питательную среду.
Укореняемость подвоев вишни достигает 80...100 %, сортов вишни — 70...80 %, подвоев яблони селекции МГАУ— 70...100 % при концентрации ИМК 0,5...1 мг/л.
После того как в пробирке получено полностью сформированное растение с хорошо развитым стеблем длиной 30...35 мм, с листьями, с корневой системой из 3...4 корней длиной 4...7 мм, его необходимо перенести в нестерильные условия, т. е. осуществить адаптацию. Это один из самых сложных этапов в системе микроклонального размножения. Адаптацию следует начинать не раньше конца февраля, лучше в марте. До начала массовой адаптации пробирочные растения можно несколько месяцев хранить в холодильной камере при температуре 2...4 °С.
Чтобы пробирочное растение при перенесении из стерильных в нестерильные условия лучше адаптировалось к жестким условиям внешней среды, субстрат (смесь низового нейтрального торфа и песка в соотношении 3:1) предварительно стерилизуют путем прогревания в течение 2...4 ч при температуре 85...90 °С, а затем выдерживают не менее 2 нед для восстановления микробиологической активности почвы. Субстратом заполняют торфяные горшочки размером 5х5 или 8х10 см. Перед высадкой в субстрат корни растений погружают в 1 %-ный раствор КМп04, чтобы уменьшить инфицированность в нестерильных условиях.
Горшочки с растениями устанавливают в ящики, которые закрывают полиэтиленовой пленкой и помещают на стеллажи под люминесцентные лампы (освещенность 2000 лк). Через 7...10 дней пленку снимают, проводят регулярный полив, каждые 10 дней подкармливают растения растворимыми минеральными удобрениями (до 2 г/л). Через месяц хорошо развитые растения пересаживают в горшочки большего размера. Через 3 мес при правильном уходе растение достигает высоты 20...30 см. Выход растений при адаптации составляет 65...80 %. Полученный супер-суперэлитный посадочный материал используют для создания суперэлитных (безвирусных) маточных насаждений (рис. 1).
Дата добавления: 2017-04-05; просмотров: 2937;











