Физико-химические основы процессов
Водоподготовки
Классификация и выбор технологических процессов
Обработки воды
Разнообразие примесей, которые должны быть удалены из воды, а также методов, применяемых при ее обработке на котельных и ТЭС, усложняют поиск оптимальных решений при выборе схем и аппаратов в каждом конкретном случае.
Поэтому очевидна необходимость классификации методов очистки и удаляемых примесей. При этом в качестве классификационных признаков используют
· физико-химическую сущность методов, применяемых при очистке без учета характера удаляемых примесей и изменения их состояния в процессе очистки;
· характер сил, воздействующих на примеси, также без учета характера примесей и изменения их состояния;
· характер подлежащих удалению примесей без учета изменения их состояния в процессе очистки;
· изменение состояния примеси в процессе очистки.
Наиболее известны классификации Л.А. Кульского и М.И. Лапшина. В основе классификации Л.А. Кульского лежит различие характера удаляемых примесей. Загрязненные воды представляют собой гомогенные или гетерогенные системы, которые соответственно подразделяются на ионные, молекулярные, коллоидные растворы и взвеси. К каждой из четырех групп вод (систем) подобраны соответствующие наиболее эффективные методы очистки воды, области их применения, состав очистных сооружений и т.д. Однако в этой классификации не учитывается характер отдельных примесей.
В классификации М.И. Лапшина, наоборот, основным классификационным признаком является характер и состояние удаляемых при очистке примесей; при этом методы очистки подразделяются на следующие группы:
· методы непосредственного выделения примесей, например отстаивание;
· методы выделения примесей с изменением фазового состояния воды или примеси, например деаэрация;
· методы превращения примесей, например образование труднорастворимых соединений (известкование);
· биохимические методы.
Обе классификации имеют достоинства и недостатки, но дополняя друг друга, помогают выбору оптимального решения схем ВПУ на котельных и ТЭС с точки зрения как повышения эффективности очистки воды, так и возможности утилизации извлеченных из нее при очистке примесей для предотвращения загрязнений окружающей среды. При выборе метода очистки в настоящее время следует учитывать в первую очередь водоисточник, производительность, который обеспечивал бы надежность, экологичность и экономичность.
Многообразие примесей в природной воде служит причиной того, что очистка добавочной воды для подпитки котлов организуется в несколько стадий на ВПУ (рис. 3.1).
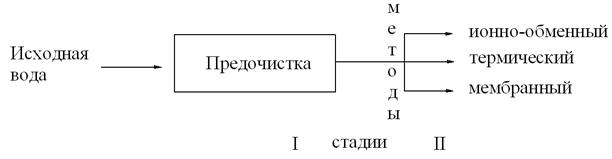
Рис. 3.1 Стадии водоочистки
На начальном этапе из воды выделяются грубодисперсные и коллоидные вещества, а также снижается бикарбонатная щелочность этой воды. На дальнейших этапах производится очистка воды от истинно-растворимых примесей.
Начальный этап очистки воды.
ПРЕДОЧИСТКА – необходима для улучшения технико-экономических показателей последующих этапов очистки воды, а также потому, что при отсутствии предочистки применение многих методов на последующих ступенях очистки встречает значительные затруднения. Так, наличие в воде органических веществ приводит к изменению технологических свойств анионитов, способствует их старению, а следовательно, к резкому (в 4–8 раз) снижению срока службы. Присутствие в воде ионов железа в концентрации свыше 50 мкг/дм3 вызывает отравление мембран при очистке воды электролизом. Неудовлетворительная очистка воды от грубодисперсных и коллоидных примесей является одной из причин образования накипей на поверхностях нагрева и ухудшению качества пара. Поэтому в настоящее время предочистке воды в схемах подготовки добавочной и подпиточной воды придается важное значение.
Предочистка воды может быть осуществлена в основном методами осаждения, при применении которых примеси выделяются из воды в виде осадка.
Эти методы называются также реагентными, так как для выделения примесей в воду дозируются специальные реагенты.
К процессам осаждения, применяемым в настоящее время при предочистке воды, относятся коагуляция, известкование и магнезиальное обескремнивание. Как правило, эти процессы совмещаются и проводятся одновременно в одном аппарате – осветлителе, что целесообразно как для улучшения суммарного технологического эффекта процесса очистки воды, так и для снижения капитальных и эксплуатационных затрат.
Первичное осветление воды производится в осветлителях, а окончательно очистка от осадка осуществляется при помощи процесса фильтрования, который также относится к предочистке воды, но является безреагентным методом.
На второй стадии вода подвергается очистке химическими (умягчение, обессоливание), термическими (получение дистиллята), мембранными методами.
Контрольные вопросы
1. В чем заключается классификация основ обработки воды?
2. Назовите известные классификации, их достоинства и недостатки?
3. На какие стадии подразделяется обработка воды?
4. Задачи предочистки.
Глава четвертая
Предварительная очистка воды
и физико-химические процессы
4.1. Очистка воды методом коагуляции
Под коагуляцией понимают физико-химический процесс слипания коллоидных частиц и образования грубодисперсной макрофазы (флоккул) с последующим ее выделением из воды. Схема коагуляционной структуры показана на рис. 4.1.
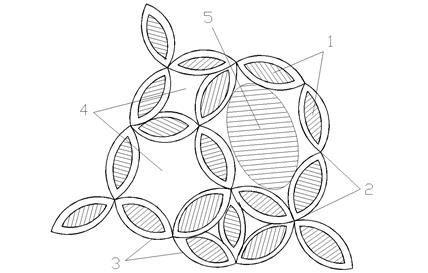
Рис. 4.1. Схема коагуляционной структуры:
1 – частицы колоидно–дисперсной фазы; 2 – дестабилизированные участки поверхности; 3 – участки поверхности, сохраняющие устойчивость; 4 – полости, заполненные водой; 5 – грубодисперсная примесь
В качестве реагентов, называемых коагулянтами, обычно применяют сернокислые соли: [Al2(SO4)3·18H2O] или (FeSO4·7H2O). Эти соли в воде почти полностью диссоциируют:
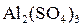  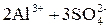 ; ;
| |
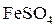  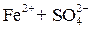 . .
|
Легко подвергаются гидролизу:
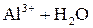  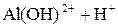 ; ; 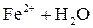  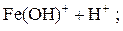
| |
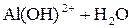  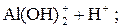 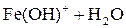  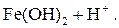
| |
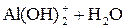  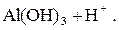
|
При pН > 8 – щелочная среда:
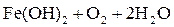  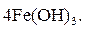
|
Выделенный Н+ при гидролизе коагулянтов связывает бикарбонат в природной воде:
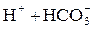  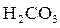  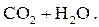
|
Таким образом, при гидролизе коагулянтов: Al2(SO4)3 и FeSO4 образуются положительные электроны и между отрицательно заряженными частицами дисперсных примесей воды возникают силы притяжения. Образуются укрупненные агрегаты, которые уже подчиняются силе тяготения. Эти агрегаты оседают или могут быть легко отфильтрованы вследствие своих уже достаточно крупных размеров.
Процесс коагуляции воды при помощи Al2(SO4)3 ведется при рН 5,5–7,5 при дозе 0,5–1,2 ммоль/дм3, а с помощью FeSO4 при рН > 8 при дозе 0,25–1,0 ммоль/дм3 необходимо коагуляцию вести с процессом известкования.
Процесс коагуляции имеет скрытую и явную стадии. На скрытой стадии происходит формирование коллоидных гидрооксидов Al3+ или Fe3+ и образование микрохлопьев. Именно на этой стадии коагуляции вода в основном и очищается от первичных примесей. А затем на второй стадии процесса образуются хлопья (флоккулы) размером 1–3 мм, которые, обладая высокой сорбционной способностью, могут дополнительно извлекать примеси воды.
При организации процесса коагуляции с использованием гидролизующихся коагулянтов необходим учет основных факторов, определяющих оптимальное осуществление технологии. Оптимальная доза коагулянта, т. е. то его минимальное количество, которое обеспечивает максимальное снижение концентрации коллоидных и грубодисперсных примесей в обрабатываемой воде, определяется главным образом качественным и количественным составом коллоидных и растворенных примесей, их физическими и физико-химическими свойствами.
В настоящее время теоретические разработки не дают возможности точного расчетного выбора необходимой дозы коагулянта, что связано, с одной стороны, с отсутствием количественных характеристик различных по составу коллоидных примесей в водах различных типов, с другой – с необходимостью учитывать при расчетах сложность совокупного механизма формирования коагулированной взвеси, когда физические процессы гетерокоагуляции сопровождаются химическими, такими как хемосорбция, образование малорастворимых гидрокомплексов, их полимеризация и кристаллизация, усложняемыми влиянием кинетических факторов. Поэтому оптимальные дозы коагулянта устанавливаются опытным путем для каждого источника водоснабжения в характерные периоды года методом параллельного введения в термостатированные сосуды с определенным объемом воды различных количеств коагулянта с последующей оценкой интенсивности хлопьеобразования, скорости оседания хлопьев и определением остаточных концентраций органических веществ, железо- и кремнесодержащих соединений, ионов алюминия.
Вспомогательные процессы и средства коагуляция обеспечивают интенсификацию и повышение технико-экономической эффективности процесса коагуляции. К их: числу относят флокуляцию – процесс агрегации частиц в котором в дополнение к непосредственному контакту частиц происходит их адсорбционное взаимодействие с молекулами высокомолекулярных веществ, называемых флокулянтами (рис 4.2). При этом ускоряются процессы образования хлопьев и их осаждение, повышается плотность агрегатов, и осадков.
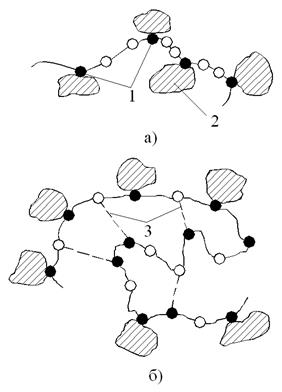
Рис. 4.2. Адсорбция микрочастиц флокулянтами:
а) вытянутая молекула; б) свёрнутая молекула;
1 – адсорбирующая группа; 2 – микрочастица; 3 – внутримолекулярная связь
Флокулянты подразделяются на неорганические и органические, природные и синтетические, на ионогенные и амфотерные. Из неорганических флокулянтов используется активная кремниевая кислота; природными органическими флокулянтами являются крахмал, карбоксиметилцеллюлоза и др. Синтетические флокулянты получили более широкое применение из-за лучших флокуляционных свойств, среди них в основном используется в настоящее время универсальный флокулянт полиакриламид (ПАА):
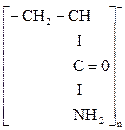 . .
|
Полиакриламид выпускается промышленностью в виде 8-процентного геля, который растворяют в быстроходных мешалках на ВПУ до концентрации 0,1 %. Дозировка флокулянта составляет 0,5–1,5 мг на 100 мг взвешенных веществ в исходной воде. Раствор ПАА вводится через 0,5–2 мин после ввода коагулянта. На рис. 4.3, 4.4 представлены схемы предочистки и осветлителя.
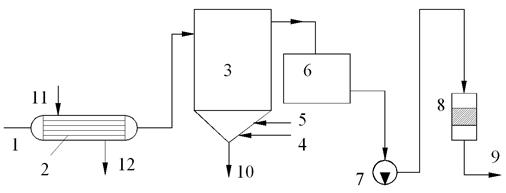
Рис. 4.3. Схема процессов известкования и коагуляции:
1 – исходная вода; 2 – теплообменный подогреватель; 3 – осветлитель; 4 – ввод извести; 5 – ввод коагулянта; 6 – бак осветлённой воды; 7 – перекачивающий насос; 8 – осветлительный фильтр; 9 – на ионитные фильтры или потребление; 10 – сброс осадка с продувочной водой; 11 – греющий пар; 12 – конденсат греющего пара
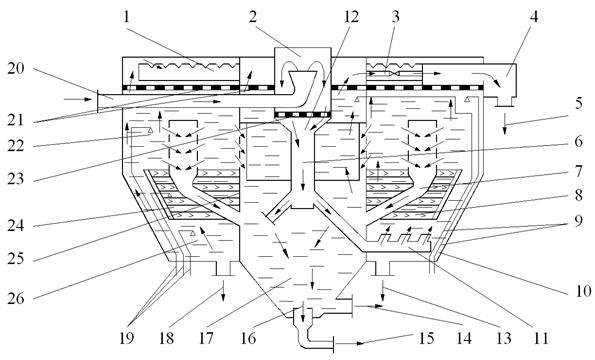
Рис. 4.4. Схема работы осветлителя:
1 – желоб для сбора осветлённой воды; 2 – воздухоотделитель; 3 – труба отвода осветлённой воды из шламоуплотнителя "отсечка"; 4 – сливочный короб; 5 – выход осветлённой воды; 6 – центральная труба; 7 – шламоотводящая труба; 8 – щелевая переборка; 9, 19 – отбор проб воды;
10 – ввод раствора коагулянта; 11 – труба с водораспределительными соплами; 12 – расвор извести; 13, 18 – дренаж; 14 – периодическая продувка; 16 – сборник шлама; 17 – шламоуплотнитель; 20 – ввод воды в осветлитель; 21 – дренажные решетки; 22 – выходная (цилиндрическая) зона осветлителя; 23 – предохранительная решетка; 24 – ввод флокулянтов;
25 – направляющий кожух; 26 – входная (коническая) зона осветлителя
4.2. Осаждение методами известкования и содоизвесткования
Известкование воды, т. е. обработка воды Са(ОН)2, применяется для снижения щелочности (декарбонизации) исходной воды, при этом одновременно уменьшаются жесткость и сухой остаток, удаляются грубодисперсные примеси, соединения железа. В подогретую до температуры около 30 °С обрабатываемую воду дозируют в виде суспензии (молока) гашеную известь Са(ОН)2. Растворяясь, ее компоненты обогащают воду ионами Ca2+ и одновременно ионами ОН-, сдвигая углекислотное равновесие в сторону образования ионов 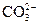 . В результате повышения их концентрации достигается произведение растворимости СаСО3. В составе этого соединения в осадок выпадает ион Ca2+, как содержащийся в исходной воде, так и введенный с известью.
. В результате повышения их концентрации достигается произведение растворимости СаСО3. В составе этого соединения в осадок выпадает ион Ca2+, как содержащийся в исходной воде, так и введенный с известью.
Качество известкованной воды оценивают по следующим показателям: остаточной щелочности, содержанию взвешенных веществ или прозрачности, жесткости с составляющими ее видами, сухому остатку и стабильности. Как отмечалось, значение фактической остаточной щелочности известкованной воды всегда получают значительно большим расчетного (равновесного) вследствие неполноты кристаллизации образующихся соединений. Вместе с тем в этом случае сохраняются действия теоретических предпосылок – чем больше остаточная концентрация Са2+ в известкованной воде (определяется, по существу, некарбонатной кальциевой жесткостью исходной воды), тем меньше остаточная карбонатная и общая щелочность. Исходя из опыта эксплуатации ВПУ, высказанное положение представлено следующими данными:
Остаточное содержание Са2+, ммоль/дм3 более 3 1,0–3,0 0,5–1,0
Щелочность, ммоль/дм3 0,5–0,6 0,6–0,7 0,7–0,8
Состав компонентов общей щелочности будет зависеть от избытка извести, т. е. рН известкованной воды. Виды щелочности по заданному значению рН можно оценить расчетным путем. При титровании известкованной воды кислотой со стандартными индикаторами обнаруживаются обычно только гидратная и карбонатная щелочности, что вносит определенные противоречия в понимание получаемых результатов.
Содержание взвешенных веществ в известкованной воде при налаженном режиме обработки не превышает обычно 10 мг/дм3. Предельно допустимое содержание их не должно быть более 20 мг/дм3. В эксплуатационной практике из-за трудоемкости и длительности определения концентрации взвешенных веществ используют косвенный показатель – прозрачность воды.
Малая нестабильность (менее 0,1 ммоль/дм3) – обязательное и важное требование к воде обработанной методами осаждения, так как при последующей транспортировке и обработке нестабильной воды происходит образование карбонатных отложений в трубопроводах, на зернах фильтрующей загрузки осветлительных, а иногда и ионообменных фильтров. В таких случаях необходимо использование кислотных промывок и более частая смена фильтрующих материалов.
Эффективность процесса известкования воды зависит от целого ряда факторов, к основным из которых относится правильное дозирование извести удовлетворительного качества, использование в необходимых случаях коагуляции, подогрев воды до строго заданной температуры, использование образовавшегося шлама для углубления процесса обработки, выбор оптимальных режимов движения обрабатываемой воды в осветлителях.
Характеристики эксплуатационных условий проведения процессов известкования и коагуляции, а также обычно наблюдаемые результаты представлены в табл. 4.1.
Таблица 4.1
Характеристика и результаты эксплуатационной обработки
воды методами осаждения
| Характеристика и результаты процесса | Известкование – коагуляция | Коагуляция в осветлителе |
| Реагенты | FeSО4, CaO, ПАА | А12(SO4)3 |
| Температура, °С | 30–40 | 25–30 |
| Состав шлама | CaCО3+Mg(OH)2+ +Fe(OH)3+MgO·SiО2 | А1(ОН)3 |
| Снижение перманганатной окисляемости, % | 40–60 | 50–75 |
| Остаточная концентрация ГДП, мг/дм3 рН | менее 10 9,5–10,2 | менее 10 5,5–7,5 |
| Углекислота свободная, мг/дм3 | удаляется полностью | возрастает на Дк·44 |
Ион 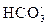 , ммоль/дм3 , ммоль/дм3
| титрованием не обнаруживается | уменьшается на Дк |
Ион 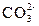 , ммоль/дм3 , ммоль/дм3
| 0,4–0,7 | – |
| Ион ОН-, ммоль/дм3 | 0,05–0,3 | – |
| Щелочность общая, ммоль/дм3 | 0,7–1,0 | снижается на Дк |
| Жесткость некарбонатная, ммоль/дм3 | увеличивается на Дк | увеличивается на Дк |
| Жесткость общая, ммоль/дм3 | Жнк + Дк + (0,8+1,2) | не изменяется |
| Кремниевая кислота, мг/дм3 | снижается на 50 % | снижается на 20 - 50 % |
| Сульфаты, ммоль/дм3 | увеличивается на Дк | увеличивается на Дк |
Технологический процесс известкования воды широко применяется на ТЭС для вод со щелочностью, превышающей 1,5 ммоль/дм3. Наряду с благоприятным изменением основных показателей качества обработанной воды (см. табл. 4.1), приводящим к экономии кислоты и щелочи при последующем химическом обессоливании известкованной воды, следует отметить, что при известковании примеси переходят в сбросные воды в виде твердой фазы, что упрощает их переработку при создании бессточных схем, а содержащиеся в продувочных водах щелочные компоненты – карбонат кальция и гидроксид магния – могут быть использованы для нейтрализации кислых стоков.
Процесс содоизвесткования как метод умягчения применим к водам практически любого состава в отличие от известкования, при котором жесткость воды, как указывалось ранее, снижается лишь на значение ее карбонатной составляющей. Для более глубокого умягчения воды необходимо ввести извне ионы 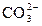 , а для выделения Mg(OH)2 требуется увеличить дозу извести. Это достигается известково-содовой обработкой воды, при которой наряду с известью дозируют также кальцинированную соду Nа2СО3, которая за счет диссоциации создает в воде избыток ионов
, а для выделения Mg(OH)2 требуется увеличить дозу извести. Это достигается известково-содовой обработкой воды, при которой наряду с известью дозируют также кальцинированную соду Nа2СО3, которая за счет диссоциации создает в воде избыток ионов 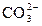 , способствующих переводу в твердую фазу ионов Са2+. Дозировку соответствующих реагентов при содоизвестковании выбирают так: извести – по уравнению, принимая повышенный избыток извести в пределах
, способствующих переводу в твердую фазу ионов Са2+. Дозировку соответствующих реагентов при содоизвестковании выбирают так: извести – по уравнению, принимая повышенный избыток извести в пределах
0,2–0,35 ммоль/дм3, соды – с учётом остаточной концентрации ионов Са2+ при известковании по формуле
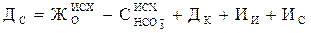 , ,
|
где Ис – избыток соды.
В отсутствие необходимости удаления коллоидных примесей (например, при обработке регенерационных стоков) потребная доза соды и извести не включает расход этих реагентов на химические реакции с участием коагулянта FeSО4.
Исходя из допустимой остаточной щелочности и экономических соображений избыток соды принимают до 1 ммоль/дм3 (ИИ = 0,2–0,35 ммоль/дм3), что обеспечивает снижение общей жесткости в содоизвесткованной воде до
0,3–0,4 ммоль/дм3. Такая глубина умягчения способствовала широкому применению этого метода до начала 30-х годов для получения добавочной воды для котлов электростанций, работающих на низком давлении. Позже этот метод был вытеснен катионообменной технологией умягчения воды. В настоящее время содоизвесткование нашло широкое применение в проектах ВПУ с запрещенным сбросом сточных вод для умягчения регенерационных стоков и их повторного использования.
Контрольные вопросы
1. Какие коагулянты применяются в процессах осаждения?
2. В чем сущность коагуляции?
3. Почему известкованная вода должна характеризоваться малой нестабильностью?
4. По каким параметрам должен оптимизироваться процесс известкования?
5. Каковы реальные значения остаточных концентраций примесей, удаляемых при известковании и содоизвестковании?
6. Напишите основные химические реакции процесса коагуляции.
Глава пятая
Дата добавления: 2017-03-12; просмотров: 4943;











