Неравенство Клаузиуса. Закон возрастания энтропии
Напомним, что согласно второй теореме Карно (см. § 10), КПД h любой тепловой машины, проходящей цикл с использованием двух тепловых резервуаров, не может превышать КПД цикла Карно (h £ hк). Обозначим температуры резервуаров ТН и ТХ (ТН > ТХ), а количества тепла, получаемые от них рабочим телом QН и QХ соответственно (QХ < 0). Тогда h£ hк, или
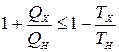 .
.
Отсюда следует, что
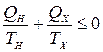 , (15.1)
, (15.1)
т.е. сумма приведенных количеств теплоты в рассматриваемом цикле меньше или равна нулю. Соотношение (15.1) представляет собой частный случай неравенство Клаузиуса для цикла, в котором рабочее тело обменивается теплом с двумя тепловыми резервуарами.
Для произвольного цикла, в котором рабочее тело контактирует с большим числом тепловых резервуаров, неравенство Клаузиуса можно получить, разбивая цикл близкими друг к другу адиабатами на большое количество элементарных циклов, аналогично тому, как было получено равенство Клаузиуса в §13. Записывая для малых циклов соотношения (15.1) и суммируя, получим неравенство Клаузиуса, справедливое для любого цикла:
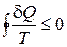 . (15.2)
. (15.2)
Здесь Т – температура теплового резервуара, от которого рабочее тело получает элементарное количество теплоты dQ. Когда все процессы в цикле обратимы, при каждом элементарном акте теплопередачи температуры рабочего тела и резервуара неотличимы, и неравенство (15.2) переходит в равенство Клаузиуса (13.3).
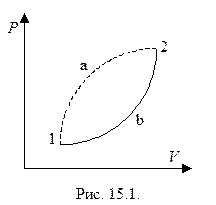 Рассмотрим произвольный процесс 1-а-2 (обратимый или необратимый), переводящий систему из состояния 1 в состояние 2 (Рис. 15.1.). Вернемся в состояние 1, используя обратимый процесс 2-b-1. Запишем неравенство Клаузиуса для цикла 1-а-2-b-1:
Рассмотрим произвольный процесс 1-а-2 (обратимый или необратимый), переводящий систему из состояния 1 в состояние 2 (Рис. 15.1.). Вернемся в состояние 1, используя обратимый процесс 2-b-1. Запишем неравенство Клаузиуса для цикла 1-а-2-b-1:
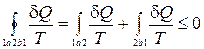 . (15.3)
. (15.3)
Для обратимого процесса 2-b-1 приведенное количество теплоты равно изменению энтропии
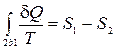 .
.
Подставляя это выражение в неравенство (15.3), получим
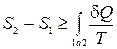 . (15.4)
. (15.4)
Таким образом, изменение энтропии в каком-либо процессе не может быть меньше приведенного количества теплоты. Неравенство (15.4) часто записывают в дифференциальной форме для бесконечно малых процессов
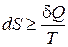 . (15.5)
. (15.5)
Если процессы обратимы, выражения (15.4) и (15.5) переходят в равенства.
Для процессов, происходящих в теплоизолированной системе, dQ = 0. Тогда из неравенств (15.4) и (15.5) следует закон возрастания энтропии: энтропия адиабатически изолированной системы не может убывать. При обратимых процессах она остается неизменной, при необратимых процессах возрастает.
Чтобы найти изменение энтропии в необратимом процессе следует рассмотреть какой-либо обратимый процесс с теми же начальным и конечным состояниями, и рассчитать для него приведенное количество тепла.
В качестве примера найдем изменение энтропии идеального газа при расширении в пустоту от объема V1 до объема V2 в теплоизолированном сосуде. Так как в этом процессе газ работу не совершает и не получает тепла, его внутренняя энергия не меняется. Для идеального газа неизменность внутренней энергии означает постоянство температуры Т. Чтобы вычислить изменение энтропии газа рассмотрим квазистатический изотермический процесс, в котором газ находится в тепловом контакте с нагревателем, имеющим температуру Т. Медленно уменьшая давление на газ можно увеличить его объем от V1 до V2. При этом газ получит от нагревателя количество тепла Q, за счет которого совершит работу А.
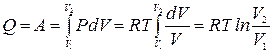 .
.
Отсюда
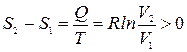 .
.
Такое же возрастание энтропии будет при расширении в пустоту, хотя газ тепла не и получает. Увеличение энтропии вызвано необратимостью процесса.
Дата добавления: 2017-03-12; просмотров: 2563;











