Процессы на T-S диаграмме
Формула (13.8) для элементарного количества тепла 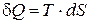 весьма похожа на формулу элементарной работы
весьма похожа на формулу элементарной работы 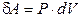 .
.
Ввиду этого сходства, Гиббс предложил называть энтропию S термодинамической координатой, а температуру Т – термодинамической силой. Так же, как работа связана с изменением механической координаты (объема), подвод тепла связан с изменением термодинамической координаты – энтропии.
T
a 2
1 b
S1 S2 S Рис. 14.1
|
Геометрическая интерпретация количества тепла на диаграмме T-S совершенно аналогична интерпретации работы на диаграмме P-V. Полученное системой количество тепла выражается формулой
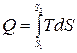 .
.
Геометрически оно равно площади фигуры, лежащей под кривой, изображающей процесс (рис. 14.1). Так как температура зависит не только от энтропии, а и от других параметров состояния (объема или давления), площадь под кривой (полученное тепло) зависит не только от начального и конечного состояний, но и от всего хода процесса (Q1a2> Q1b2).
Рассмотрим цикл 1-а-2-b-1. На участке 1-а-2 энтропия растет, и система получает положительное количество тепла, равное площади фигуры 1-а-2-S2-S1-1. На участке 2-b-1 энтропия уменьшается, и система получает отрицательное количество тепла, абсолютная величина которого равна площади фигуры 2-b-1-S1-S2-1. Полное количество тепла Q, полученное системой при прохождении цикла, равно площади фигуры 1-а-2-b-1 (площади цикла). Так как внутренняя энергия U – функция состояния, ее изменение при обходе цикла равно нулю. Тогда из первого начала термодинамики следует, что Q = A, где А – полная работа, совершаемая системой за цикл. Таким образом, площади циклов на P-V плоскости и на T-S плоскости одинаковы.
Политропическим процессом (политропой) называют процесс, проходящей с постоянной теплоемкостью С. Найдем уравнение политропы в переменных T-S. Согласно определениям теплоемкости и энтропии, можно записать
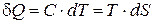 .
.
Разделяя переменные, получим
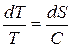 .
.
Интегрируя, найдем уравнение политропы, проходящей через точку (S0,T0)
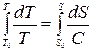 ,
, 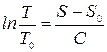 .
.
Окончательно получим
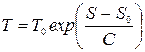 . (14.1)
. (14.1)
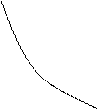
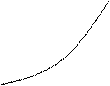
C<0 CV CP
T0 C = ¥
S0 S Рис. 14.2 |
Таким образом, на T-S плоскости политропы с разными теплоемкостями образуют систему экспоненциальных кривых. На рис. 14.2 изображены изотерма (С = ¥), адиабата (С = 0), изохора (С = СV), изобара (С = СР) и одна из политроп с отрицательной теплоемкостью (С< 0).
Подставляя в уравнение (14.1) выражение для изменения энтропии идеального газа можно получить уравнение политропы идеального газа в переменных T-V:
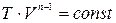 ,
,
где n = (C – CP)/(C – CV) называется показателем политропы.
В переменных P-V уравнение политропы для идеального газа имеет вид:
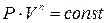 .
.
Цикл Карно на T-S диаграмме всегда изображается прямоугольником, стороны которого параллельны координатным осям, тогда как на P-V диаграмме его форма зависит от вида рабочего вещества.
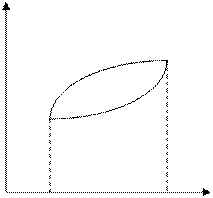
Докажем теорему: КПД цикла Карно больше, чем КПД любого обратимого цикла (отличного от цикла Карно), в котором максимальная температура равна температуре нагревателя, а минимальная – температуре холодильника в цикле Карно.
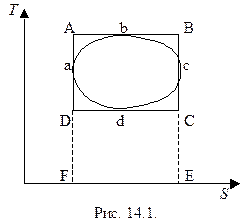 Для доказательства изобразим на T-S плоскости заданный цикл abcd и опишем вокруг него цикл Карно ABCD (рис. 14.3). КПД цикла Карно
Для доказательства изобразим на T-S плоскости заданный цикл abcd и опишем вокруг него цикл Карно ABCD (рис. 14.3). КПД цикла Карно
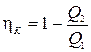 ,
,
где полученное от нагревателя количество тепла Q1 изображается на диаграмме площадью прямоугольника ABFE, а тепло Q2, отданное холодильнику, - площадью прямоугольника DCFE.
Обозначим сумму площадей фигур aAb и bBc через q1 (q1 > 0), а сумму площадей aDd и cCd через q2 (q2 > 0). Тогда КПД цикла abcd
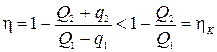 .
.
Таким образом hК > h. Теорема доказана.
Дата добавления: 2017-03-12; просмотров: 5534;






 T C=0
T C=0









