Растворов электролитов
Константа равновесия любого химического процесса, в том числе и диссоциации, выраженная через активность, записывается следующим образом:
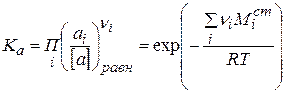 (2.38)
(2.38)
Из уравнения изотермы химической реакции активность иона 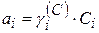 .
. 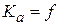 (Т, природы растворителя).
(Т, природы растворителя).
Для примера рассмотрим диссоциацию одноосновной кислоты в водном растворе:
HA + H2O ⇆ H3O+ + A-
Протон Н+ в природе не существует, в водных растворах он всегда гидратирован молекулами и существует в виде иона гидроксония.
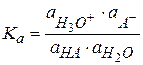 (2.39)
(2.39)
Обычно в растворах С0,1≫С0,2, т.е. концентрация растворителя значительно больше концентрации растворенного вещества.
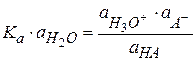 (2.40)
(2.40)
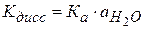
Кдисс включает в себя произведение Кравн. на активность воды.
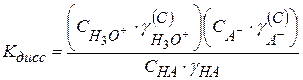 (2.41)
(2.41)
Перегруппируем
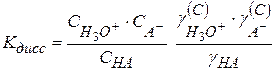 (2.42)
(2.42)
Активности катиона и аниона определить невозможно; активность молекулярной формы принято считать равной единице.
Тогда
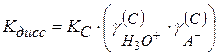 (2.43)
(2.43)
Известно, что
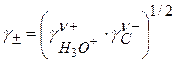
Для одноосновной кислоты
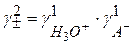
С учетом этого
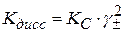 (2.44)
(2.44)
Кс – концентрационная константа диссоциации, которая зависит от С, Т и природы растворителя. Выразим Кс через степень электролитической диссоциации α:
НА +Н2О ⇆ Н3О+ +А⁻

Степень диссоциации электролита
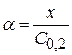
Отсюда
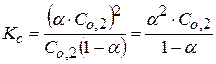 - это уравнение является законом разведения Оствальда.
- это уравнение является законом разведения Оствальда.
Значение константы Кс можно определить экспериментальным путем по значению α:
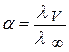
λ ∞ рассчитывают по уравнению Кольрауша:
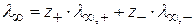
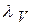 определяется кондуктометрическим методом.
определяется кондуктометрическим методом.
Прологарифмируем уравнение (2.44)
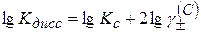 (2.45)
(2.45)
Значение 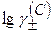 определяют по уравнению Дебая-Хюккеля:
определяют по уравнению Дебая-Хюккеля:
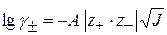
Для НА 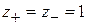 , тогда
, тогда 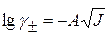
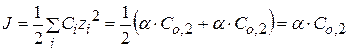
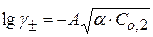
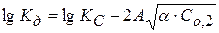
или
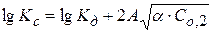
Рассчитав ионную силу раствора и экспериментально определив Kc, можно найти величину Кдисс.

Найденная константа Кдисс. экстраполирована на нулевую точку, при которой J =0
Кдисс.=f (Т,Р, природа растворителя)
Kc =f (Р,Т,С, природа растворителя), т.е. Кдисс.≠ f(C)
В справочниках приводятся значения рК=−lg Кдисс.
Для кислот – рКa (или рКА)
Для оснований рКв (или рКВ)
рКА или рКВ – показатель константы диссоциации кислоты и основания.
Если рК = 9÷16 – очень слабые электролиты,
рК = 3÷9 – слабые электролиты,
рК ≤ 3 – умеренно слабые электролиты.
Кислотно-основная теория Бренстеда
Теория Аррениуса широко применяется к трактовке различных кислотно-основных равновесий или протолитических равновесий. Согласно этой теории кислотой (НА) является соединение, диссоциирующее на протоны Н+ и кислотный остаток:
НА ⇆ Н+ + А−,
а основанием является соединение, диссоциирующее на катионы металла и ионы гидроксила:
ВОН ⇆ В+ + ОН-
Более широкую практику кислотно-основных равновесий дает теория Бренстеда. Согласно этой теории кислота – донор протона, основание − акцептор протона. При протолитическом равновесии образуются кислотно-основные пары.
Например, в реакции (диссоциация)
HCI + H2O ⇆ H3O+ + CI-
молекула HCI – кислота, H2O – основание.
В определенных условиях ион Н3О+ может отдать CI- - иону протон. В этом случае H3O+ - кислота, а ион CI- - основание, сопряженное с HCI.
Н3О+ + CI- → HCI + H2O
Одно и тоже вещество в определенных условиях может проявлять кислотные или основные свойства.
Например, уксусная кислота является кислотой по отношению к воде и основанием по отношению к более сильной серной кислоте, принимая от нее протон.
Дата добавления: 2017-03-12; просмотров: 1743;











