Зависимость молярной электропроводимости от температуры
Изменение электропроводимости раствора проводят в термостате, т.к. она в сильной степени зависит от температуры. Это связано:
1. С изменением вязкости среды (стоксовское сопротивление среды движению ионов). С увеличением температуры вязкость уменьшается, скорость иона возрастает.
2. С уменьшением степени гидратации (сольватации) ионов с повышением Т, при этом увеличивается подвижность ионов.
3. В области 70-1000С резко уменьшается диэлектрическая постоянная воды, → резко уменьшается диссоциация воды а, следовательно, и электропроводимость.
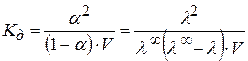 (2.37)
(2.37)
Где V – разведение электролита (V=1/c)
При кондуктометрическом титровании растворов электролитов точка эквивалентности определятся по излому кривой зависимости электрической проводимости титруемого раствора от количества титранта. Резкое изменение электрической проводимости происходит при образовании в процессе титрования малодиссоциируемых и трудно растворимых соединений.
Рассмотрим некоторые примеры:
1. Титрование сильной кислоты щелочью

а) При растворении в воде HCI диссоциирует HCI + H2O ⇆ H3O+ + CI- подвижность H3O+ больше в 7 раз подвижностей остальных ионов, æ=æmax (λ=λmax)
б) При добавлении NaOH
H3O+ + OH- = 2H2O
 количество ионов H3O+ уменьшается, электропроводность снижается до точки эквивалентности.
количество ионов H3O+ уменьшается, электропроводность снижается до точки эквивалентности.
в) В точке эквивалентности нет ионов H3O+ и OH-, есть только ионы Na+ и CI-, самая низкая электропроводимость.
г) После точки эквивалентности накапливаются гидроксид ионы (OH-) электропроводимость опять возрастает. 

Если вместо NaOH взять любую щелочь (NH4OH), α =10-2, то линия после точки эвтектики пойдет ниже
NH4OH ⇆ NH4+ + OH-
NH4OH + H3O+ = 2H2O + NH4+
2. Титрование слабой кислоты щелочью.
Муравьиная кислота – HCOOH
HCOOH + NaOH ⇆ H3O+ + HCOONa + H2O
а) HCOOH + H2O ⇆ H3O+ + HCOO- - плохая диссоциация - плохая электропроводность.
б) HCOOH + Na+ + OH- = H2O + HCOO- + Na+ - слабое возрастание электропроводимости за счет Na+ и СH3COO-
в) в точке эквивалентности 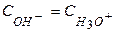
 г) NaOH избыток, возрастание электропроводимости за счет и OH- - ионов.
г) NaOH избыток, возрастание электропроводимости за счет и OH- - ионов.
3. Титрование смеси двух кислот.
Вначале титруется сильная кислота, а затем слабая кислота. Например, смесь HCI + HCOOH .
V1 – объем, пошедший на титрование HCI
 (V2‒V1) – объем щелочи, пошедший на титрование HCOOH.
(V2‒V1) – объем щелочи, пошедший на титрование HCOOH.
СNaOH V1 = Vпробы CHCI
CHCI = 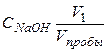
СHCOOH = 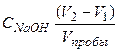
4. Титрование смеси кислоты и соли
Смесь: H2SO4 + CuSO4
Первый участок титрования: H2SO4 + 2NaOH
V1 – объем пошедший на титрование H2SO4
H3O++SO42-+2Na++2OH-=2Na++SO42-+2H2O
Второй участок титрования: CuSO4+2NaOH→Cu(OH)2+2Na++SO42-
Электропроводность практически не меняется, т.к. ионы (Cu2++SO42-) заменяются на (2Na++SO42-).
Третий участок титрования: накопление гидроксид ионов, электропроводность возрастает.
 Кондуктометрическое титрование широко применяется при титровании мутных и окрашенных растворов, где обычным объемным методом титрования сложно по изменению окраски в присутствии индикаторов определить точку эквивалентности, а также для титрования многокомпонентных смесей. Электрохимические методы титрования более точные.
Кондуктометрическое титрование широко применяется при титровании мутных и окрашенных растворов, где обычным объемным методом титрования сложно по изменению окраски в присутствии индикаторов определить точку эквивалентности, а также для титрования многокомпонентных смесей. Электрохимические методы титрования более точные.
Дата добавления: 2017-03-12; просмотров: 2007;











