ЭДС гальванического элемента
Изменение энергии Гиббса в ходе химического процесса:
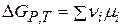
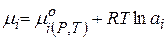 (чаще всего концентрация в С - шкале).
(чаще всего концентрация в С - шкале).
Для газовых электродов:
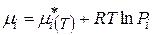
Тогда 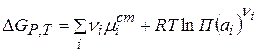
Изменение энергии Гиббса в ходе электрохимической реакции
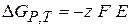
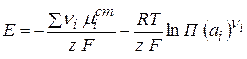 (2.57)
(2.57)
Это постоянная величина при заданных давлении и температуре, она называется стандартная ЭДС гальванического элемента – Е0 и определяется только природой реакции.
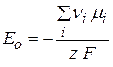 (2.58)
(2.58)
Исходя из изотермы химической реакции, можно записать выражение для Е0:
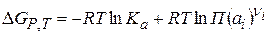
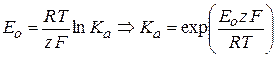 (2.59)
(2.59)
Исходя из этого, можно записать уравнение Нернста для определения ЭДС гальванического элемента:
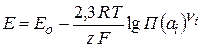 (2.60)
(2.60)
R, T, F не зависят от природы реакции, вводится сonst:
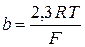 (2.61)
(2.61)
При Т=298 К (250С) 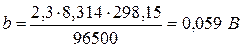
При 293 К 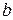 =0,058
=0,058
Выражение для расчета ЭДС примет вид:
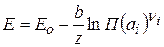 (2.62)
(2.62)
Для гальванического элемента Даниэля-Якоби:
Zn – 2e = Zn2+ (Окисление)
Cu2+ + 2e = Cu0 (восстановление)
Zn + Cu2+ = Cu0 + Zn2+
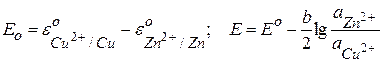
Литература
а) основная
1. Физическая химия. В 2-х кн./под ред. К.С.Краснова. М.: Высшая школа, 2001. -512 с.
2. Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа, 1999. 528 с.
3. Основы физической химии. Теория и задачи: Учебное пособие для вузов/В.В.Еремин, С.И.Каргов, И.А.Успенская, Н.Е.Кузьменко, В.В.Лунин. М.: Изд-во «Экзамен», 2005. -480 с.
4. Основы физической химии/Горшков В.И., Кузнецов А.И. М.: БИНОМ. Лаборатория знаний, 2006. -407 с.
5. Дамаскин Б.Б., Петрий О.А., Цирлина Г.А. Электрохимия. М.: Химия, 2001. -320 с.
б) дополнительная
6. Зимон А.Д. Физическая химия: Учебник для вузов. М.: Агар, 2003. -320 с.
7. Кубасов А.А. Химическая кинетика и катализ. Избранные главы из книги. 1998.
Дата добавления: 2017-03-12; просмотров: 2126;











