Локальные виды коррозии
Межкристаллитная коррозия (МКК) - преимущественное разрушение границ зерен поликристаллического металла при пренебрежимо малой скорости общей коррозии. МКК в той или иной степени подвержены коррозионностойкие стали всех структурных классов – ферритные, мартенситные, аустенитно-ферритные, аустенитные, а также дисперсионно-твердеющие алюминиевые сплавы.
Условия возникновения МКК сталей и алюминиевых сплавов различны, но характер проявления практически одинаков: при общей высокой коррозионной стойкости происходит избирательное растворение границ зерен.
Причины МКК:
- высокое содержание углерода и отсутствие стабилизирующих элементов (для хромонокелевых сталей);
- неправильно проведенная термообработка;
- технологические операции в опасном температурном интервале (сварка, штамповка, ковка, волочение и др.);
- длительная эксплуатация при повышенной температуре;
- неправильный выбор структурного класса для эксплуатации в определенной коррозионной среде.
В сварных соединениях МКК может возникать: а) в основном металле, в зоне термического влияния, где металл подвержен нагреву в области опасных температур; б) на границе наплавленного металла и основного металла – в виде ножевой коррозии; в) в наплавленном металле.
МКК коррозионностойких сталей наблюдается обычно после термообработки, приводящей к образованию на границах зерен каких-либо новых фаз, чаще всего карбидов. Их причиной образования является различная зависимость растворимости углерода от температуры в фазах.
В хромистых ферритных сталях растворимость углерода низка, поэтому в них карбиды по границам зерен выпадают уже в процессе охлаждения от высоких температур. Отжиг ферритных сталей при 600-800оС приводит к исчезновению склонности к МКК из-за коагуляции выделений карбидов.
В сталях аустенитного и аустенитно-ферритного класса углерод имеет относительно более высокую растворимость и закалка позволяет зафиксировать состояние твердого раствора углерода, поэтому карбиды не образуются. Их образование происходит только при отпуске или замедленном охлаждении.
Теории МКК. 1. Теория обеднения - наиболее распространенная и экспериментально подтвержденная теория, объясняющая МКК в слабоокислительных средах. Основная причина МКК – обеднение границ зерен аустенита хромом, находящимся в состоянии твердого раствора, в результате образования по границам зерен при отпуске закаленных сталей богатых хромом фаз, таких как (Fe,Cr)23C6 или Cr3C.
Уменьшение концентрации хрома в области границы зерна ниже критической, обеспечивающей возможность пассивирования, приводит к образованию локального гальванического элемента, в котором пассивное тело зерна является катодом, а периферийные участки (граница зерна), находящиеся в активном состоянии – анодом.
При более высокой скорости диффузии углерода, по сравнению со скоростью диффузии хрома, необходимый для образования карбида углерод поставляется с границ зерен, из прилегающих областей, и из тела зерна. Хром в начале процесса образования Cr3C поступает с границ или прилегающих участков, поэтому диффузия не успевает восполнять израсходованное количество хрома. Но чем выше температура, тем выше скорость диффузии хрома, поэтому, чем выше температура отжига, тем ниже склонность к МКК.
Теория химически нестойкой фазы основана на фактах разрушения границ зерен в окислительных и сильно окислительных средах (HNO3). Наблюдается при образовании фаз, содержащих молибден (карбидов, σ-фаза и др.).
Теория микроэлементов- при контакте коррозионной среды и коррозионностойкой стали, имеющей выделения карбидов по границам зерен, образуется микроэлемент. Он локализуется около карбида (катода), а обедненные хромом прилегающие к нему участки – аноды – сильно корродируют. Развитие МКК по этому механизму связано с образованием сплошных или слабо разобщенных карбидных выделений.
Теория напряжений - напряжения, возникающие при образовании и росте карбидной фазы на границах зерен приводят к возникновению разности потенциалов, облегчению протекания анодного процесса.
Теория сегрегаций - образовании сегрегаций углерода и хрома по границам зерен в рамках теории обеднения при кратковременных нагревах.
В области перехода из активного состояние в пассивное наиболее достоверен механизм обеднения границ; в пассивной области ─ механизм обеднения; в транспассивной области преобладает сегрегационный механизм.
Способы борьбы с МКК нержавеющих сталей: 1) снижение содержания углерода до предела его растворимости при соотвествующих температурах; 2) закалка или перезакалка с целью перевода хрома и углерода в состояние твердого раствора; 3) легирование стали карбидообразующими элементами ─ титаном, ниобием, танталом, которые связывают углерод в соответствующие карбиды, где хром находится в состоянии твердого раствора; 4) длительный нагрев (более двух часов) сталей при достаточно высоких температурах (550 - 900оС) с целью коагуляции карбидов; 5) аустенизация.
Для алюминиевых сплавов термическая обработка (искусственное старение), проводящаяся для упрочнения (дисперсионное твердение) вызывает понижение коррозионной стойкости. Склонность к МКК магналиев (сплавов алюминия с 5 - 10% Mg) можно устранить отпуском при 250 - 400оС. В указанной области температур происходит коагуляция анодных частиц Mg2Al3, что нарушает непрерывность цепочки выделений этой фазы.
Питтинговая коррозия (ПК)- точечная коррозия (местная коррозия металла в виде отдельных точечных поражений) проявляется на металлах, находящихся в пассивном состоянии, когда коррозии с высокой скоростью подвергаются отдельные небольшие участки поверхности, что приводит к образованию глубоких поражений – точечных язв, или питтингов. ПК проявляется в окислительных средах в присутствии активирующих галогенид-ионов (Cl‾, Br‾, J‾), сульфат-иона ( 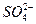 ), в смесях соляной и азотной кислот, в морской воде, в хлоридных растворах железа, хлористого натрия и др.
), в смесях соляной и азотной кислот, в морской воде, в хлоридных растворах железа, хлористого натрия и др.
Механизмы питтинговой коррозии: а) механизм проникновения аниона – миграция анионов через оксидную пленку к границе раздела МеО/Ме под влиянием электрического поля напряженностью 1мВ/см2; б) механическое разрушение пассивной пленки, которое вызывается проникновением электролита через ослабленный участок поверхности металла, при этом агрессивные ионы предотвращает репассивацию поверхности. Разрушение пленки происходит под влиянием электрострикции, вызванной адсорбцией анионов Cl‾; и) адсорбционный механизм – адсорбция активирующих анионов на определенных участках поверхности пассивирующего оксида. Адсорбированные анионы образуют поверхностные комплексы с металлическими ионами, вытесняя кислород из решетки оксида. Это облегчает переход ионов металла в электролит и вызывает уменьшение толщины оксидной пленки, которое сопровождается увеличением напряженности электрического поля, и, следовательно, увеличением скорости миграции металлических ионов.
Растворение металла в питтинге имеет электрохимическую природу - поверхность питтинга является анодом, поверхность металла с пассивной пленкой МеmОn – катодом.
Развитие питтинга идет в несколько стадий: 1) нарушение пассивности; 2) возникновение питтинга; 3) начальный этап роста питтинга (характеризуется непрерывным ростом тока и появлением первых питтингов размером несколько микрометров); 4) репассивация, или прекращение роста питтинга наступает (если возможно) после второй стадии и характеризуется возвратом системы в пассивное состояние, питтинг зарастает; 5) стабильный рост питтинга.
На стадии 2) возникновения питтинга растворяются структурные элементы поверхности металла под участками с менее совершенной пассивацией, имеющими более отрицательное значение Епо, чем остальные участки запассивированной поверхности. Несовершенства поверхности связаны с искажениями структуры: границы зерен, выходы дислокаций, металлические и неметаллические включения, выходом на поверхность металла кристаллитов с менее благоприятной для пассивации ориентацией, сегрегациями примесей. Питтинг на этом этапе представляет собой ямку от растворившегося кристалла. Если образование предпиттинга связано с менее благоприятными для пассивации структурными включениями, но изменений концентрации коррозионной среды, то предпиттинг репассивирует. Но если после растворения дефектного участка в зародыше питтинга повышается активность среды (Cl‾, H+), то развитие питтинга перейдет во вторую фазу, когда по мере протекания коррозионного процесса в питтинге агрессивность среды сильно возрастает, и среда подкисляется вследствие гидролиза растворяющихся ионов металла: Ме→Меn++ne; Меn++H2O→Me(OH)(n-1)+ +H+.
Особенностью стадии 3, является возможность репассивации, которая может произойти вследствие смещения потенциала металла в более отрицательную область потенциалов, в область устойчивой пассивности. Причиной репассивации может являться также переход ионов легирующих добавок в металле (Mo, Si, W, Re, Ru) в виде оксоанионов ( 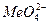 ), которые осаждаются на его поверхности, вытесняя ионы Cl‾. Это вызывает торможение анодного процесса в питтинге и репассивацию последнего.
), которые осаждаются на его поверхности, вытесняя ионы Cl‾. Это вызывает торможение анодного процесса в питтинге и репассивацию последнего.
В отсутствие репассивации начинается стабильный рост питтинга. Происходит дальнейшее повышение агрессивности среды. Возрастание потенциала в питтинге, вызванное ограничением доступа электролита по мере увеличения глубины питтинга, будет несколько снижать скорость его роста, однако репассивация не произойдет – установиться стабильный режим роста питтинга (стадия 5).
Механизм и склонность к питтинговой коррозии обычно оценивается по анодным поляризациолнным кривым (рис.4.23).
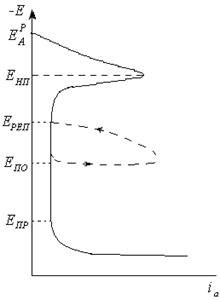
Рис. 4.23. Обобщенная анодная поляризационная кривая: Енп – потенциал начала пассивации; Ереп – потенциала репассивации; Епо- потенциал питтингообразования; Епр- потенциал перепассивации; потенциал питтингообразования (Епо) – минимальное значение потенциала, при котором возникает ПК, характеризуется устойчивым увеличением тока на поляризационной кривой при достижении потенциала Е> Епо; потенциал репассивации (Ереп) – потенциал, при котором прекращается работа питтингов, возникающих при Е> Епо.
Методы защиты от питтиговой коррозии.
1. Выбор сплава - устойчивы Сг-стали. Более высокой стойкостью к ПК отличаются высокохромистые ферритные стали повышенной чистоты по примесям внедрения, содержащие 18 или 25 - 29 % Сг, а также эти стали, дополнительно легированные 1 - 4 % Мо. Из аустенитных сталей наиболее стойки к ПК стали, легированные 2 - 3 % Мо, - Х18Н12М2Т и Х18Н12МЗТ, а также с более высоким содержанием Мо, например 03Х18АГЗН12М5. Стали Х20Н20, содержащие > 3 % Si, также отличаются повышенной стойкостью к ПК.
В очень агрессивных условиях: (при повышении концентрации галоидных анионов и температуры) следует использовать Ti или его сплавы Ti - (0,15 + 0,20) % Pd, TI - 2,5 % Ni - 2 % Zr, Ti - 2 % Ni - (1 + 2) % Mo -наиболее стойкие к ПК из доступных конструкционных материалов.
2. Электрохимическая защита и применение ингибиторов. Для предотвращения ПК можно сместить потенциал сплава или в сторону менее положительных значений пассивной области в область Епо - Епп (анодная), или отрицательнее стационарного потенциала Ест (катодная).
Надежность применения анодной защиты сталей от ПК повышается в случае присутствия ингибиторов в растворе - NaN03,гипофосфита натрия, нитратов, хроматов, сульфатов, щелочей и органических ингибиторов.
Дата добавления: 2017-02-13; просмотров: 2562;











