Введение ингибиторов
Ингибиторами называются вещества, введение незначительного количества которых в коррозионную среду существенно уменьшает скорость коррозии. По влиянию ингибитора на ту или иную стадию коррозионного процесса различают анодные и катодные ингибиторы, а также ингибиторы смешанного действия. По механизму действия ингибиторы делятся на дне группы: а) увеличивающие поляризуемость электродных процессов без образования на поверхности металла пассивирующей пленки и б) переводящий металл в пассивное состояние за счет формирования на его поверхности тонких пленок.
Эффективность ингибиторов характеризуется величиной защитного действия:
Z= 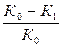 .100%, (5.14)
.100%, (5.14)
где K0 - скорость растворения металла без ингибитора, K1 - при введении ингибитора в коррозионную среду.
В качестве ингибиторов часто применяются такие вещества, как сульфит натрия, гидразин, соли мышьяка и висмута, а также пассиваторы Na2СrО4, NaNO3 и ряд других неорганических и органических веществ.
Защитные покрытия
Для защиты от электрохимической коррозии применяются те же виды покрытий, как и для защиты от газовой коррозии. Отличием является подразделение металлических покрытий на катодные и анодные. Основные технологии нанесения защитных покрытий рассматривались в гл. 3.2.
Следует напомнить, что все покрытия, за исключением покрытий, получаемых методами наплавки, прокатки, сварки взрывом, обладают той или иной степенью пористости, в том числе и сквозной. Пористость уменьшают поверхностной переплавкой (например лазером), или пропиткой смолами и красками. Для катодных покрытий пористость ухудшает их защитные свойства, в анодных покрытиях более развитая поверхность увеличивает токоотдачу и повышает защитные свойства.
Для защиты от атмосферной коррозии, а также в слабоагрессивных средах, наиболее распространенным методом получения покрытий является гальванический метод, основанный на электроосаждении металла покрытия из электролита на поверхность защищаемого изделия.
Гальванические покрытия. Количественный расчет параметров режима нанесения и толщины покрытия определяется законами электролиза, согласно которым масса осажденного металла пропорциональна току и длительности электролиза, электрохимическому эквиваленту металла покрытия и выходу по току, представляющему собой КПД процесса:
Δm=I·С·τ·η, (5.14)
где: электрохимический эквивалент, С (г/А·ч), представляет собой атомную массу металла, деленную на валентность его иона и число Фарадея, выраженное в Ампер-часах (F= 26,8 А·ч):
С= 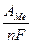 . (5.15)
. (5.15)
Толщина покрытия (в мкм) может быть получена из выражения:
h= 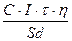 =
= 
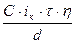 , (5.16)
, (5.16)
где d - плотность металла покрытия, г/см3; iк - катодная плотность тока, А/см2. Выражение 5.16 используется для расчета какого-либо из параметров процесса осаждения (h, iк, ,τ) при известных остальных параметрах. Режим нанесения также определяется требованиями получения высокого качества и декоративного вида покрытия.
По соотношению потенциалов металла - основы и металла-покрытия различают анодные (более электроотрицательные) и катодные (более электроположительные) покрытия. В зависимости от условий и характера контроля коррозионного процесса механизм защитного действия этих покрытий может быть различным: механическим (изоляция от коррозионной среды) и электрохимическим (поляризация основного металла). Суть второго механизма рассматривается в гл. 5.4.
Оксидирование металлов.Анодным оксидированием (анодированием) металлов называют процесс получения на поверхности металла оксидных пленок различной толщины для защиты от атмосферной коррозии. Металл, поверхность которого подлежит анодированию, опускается в специальный раствор и подключается к положительному полюсу источника тока в качестве анода.
Анодное оксидирование металлов используется для повышения коррозионной стойкости изделия, улучшения адгезионной способности поверхности к лакокрасочным, полимерным, а иногда и гальваническим покрытиям. Анодирование широко используют для получения на поверхности металла твердого слоя оксида (толстостенное анодирование алюминия и его сплавов с образованием Al2O3), стойкого к истиранию, для получения электроизолирующих слоев (в конденсаторах), для создания теплоизолирующих слоев и др.
По характеру протекания процесса, по свойствам получаемых оксидных пленок и, прежде всего, по их толщине, все растворы для анодирования можно разделить на три группы.
В растворах, не растворяющих или весьма слабо растворяющих оксид, рост пленки оксида ограничивается весьма малыми толщинами (от 0,1 до 1 мкм) вследствие большого омического сопротивления пленки оксида. Такие пленки используются в электротехнической промышленности (конденсаторы, выпрямители и др.).
В растворах, активно растворяющих оксиды, толстых пленок оксидов получить также не удается вследствие высокой скорости растворения оксидов. В таких растворах пленки получаются сильно перфорированные.
В растворах умеренной активности в зависимости от режима анодирования можно получать пленки оксидов, изменяющиеся по толщине и по свойствами в достаточно широких пределах. Для алюминия и его сплавов можно получать оксиды толщиной от 1 до 300 мкм. Оксидные пленка на алюминиевых сплавах толщиной от 20 до 50 мкм используют преимущественно для защиты изделий от коррозии. Деление растворов для анодного оксидирования металлов на три группы является в определенной мере условным. Практически в любом растворе наряду с образованием оксида (на аноде) происходит его частичное растворение. Поэтому на аноде протекает одновременно несколько процессов. Так, при оксидировании алюминия протекают следующие анодные реакции: 2Al + ЗН2О – 6е → Al2О3 +6Н+ (5.16, а)
2H2О – 4e → О2 + 4Н+ (5.16, б)
Al2O3 + 6Н+ → 2Al3+ + ЗH2О (5.16,в)
Реакция (5.16, а) способствует образованию оксида, а реакция (5.16, в) - его растворению.
Наличие нескольких анодных реакций при анодном оксидировании металлов, конечно, оказывает влияние на параметры оксидирования; толщина оксида, выход по току, время оксидирования я др.
Необходимый для окисления металла кислород поступает из раствора. Донорами кислорода могут быть кислородсодержащее анионы раствора ванны анодирования, например, SO4-, HSO 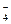 , PO
, PO 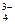 , СrО
, СrО 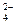 , Cr
, Cr 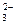 , OH- и др., а также недиссоциированные молекулы в растворе, в первую очередь молекулы воды.
, OH- и др., а также недиссоциированные молекулы в растворе, в первую очередь молекулы воды.
Анодное оксидирование металлов проводят при достаточно высоких (положительных) потенциалах анода. По различным причинам потенциал анода может достичь такой величины, при которой возможно выделение на аноде газообразного кислорода. Расход тока на образование газообразного кислорода не является полезным.
Электрохимическая полировка металлов также осуществляется на поверхности анода. При определенной совокупности параметров процесса (состав раствора, плотность тока и др.) поверхность анода избирательно растворяется, При этом происходит сглаживание первоначальной шероховатости поверхности и поверхность становится блестящей, т. е. достигается эффект, внешне аналогичный получаемому при механическом полировании.
Электрохимическая полировка используется с целью улучшения многих поверхностных свойств металлов. В частности, электрополировка используется как средство защиты металлов от коррозии за счёт образования тонкой и эластичной пленка оксида металла, улучшения микрогеометрии поверхности, снятая наклепа, уменьшения наводороживания и т. д.
Электрополировка осуществляется также при высоких положительных потенциалах и поэтому часто сопровождается выделением газообразного кислорода в качестве побочного продукта.
Пример 5.2. Стальная деталь подвергается электрополировке в смешанных растворе ортофосфорной, серной кислот и хромового ангидрида. Сила тока при электрополировке 1,30 А, анодная плотность тока 40 А/дм2, продолжительность процесса 6 мин. В этих условиях выделилось 14,1 мл кислорода. Рассчитать: 1) долю анодного тока, приходящегося на процесс электрохимического растворения стали, если на анодно поляризуемой детали протекает только два процесса – растворение металла и выделение газообразного кислорода; 2) глубину растворения металла за время процесса (углеродистой составляющей процесса пренебречь), если железо в этих условиях окисляется и переходит в раствор в виде ионов Fe3+. Плотность стали d = 7,8 г/см3.
Решение. 1) Определим электрохимические эквиваленты железа и кислорода:
ЭFe= 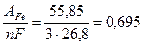 г/А.ч; Э
г/А.ч; Э 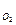 =
= 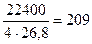 мг/(А.ч).
мг/(А.ч).
2) Общее количество электричества в процессе электрополировки:
Q= I.τ = 1,3 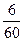 = 0,13 А.ч.
= 0,13 А.ч.
3) Количество электричества, затраченное на выделение кислорода:
Q 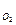 =
= 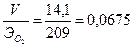 А.ч.
А.ч.
4) Доля анодного тока, идущая на растворение железа:
ВТ=6=48%.
5) Глубина съема металла при электрополировке:
h= 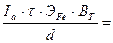
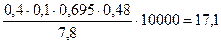 мкм.
мкм.
Дата добавления: 2017-02-13; просмотров: 2162;











