Уменьшение содержания деполяризатора.
Поскольку скорость коррозионного процесса существенно зависит от содержания в коррозионной среде деполяризатора, то в ряде случаев снижение его концентрации оказывается эффективным способом борьбы с коррозионным разрушением металлических материалов. Наиболее часто встречающимся методом защита этого типа является удаление из растворов кислорода, а для кислых сред - их нейтрализация.
Удаление кислорода из воды, являющейся наиболее распространенной коррозионной средой, осуществляется термическим, десорбционным, химическими и некоторыми другими способами.
Термический способ снижения концентрации кислорода основан на экзотермическом характере растворения молекулярного кислорода в воде, в силу чего с повышением температуры раствора равновесная концентрация кислорода в нем уменьшается. Кроме того, в соответствии с законом Генри, удалению кислорода способствует понижение его парциального давления над раствором.
Таким образом, равновесная концентрация кислорода в воде будет определяться как температурой, так и парциальным давлением кислорода над раствором:
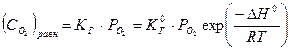 , (5.6)
, (5.6)
где KГ – постоянная Генри; 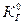 – предэкспоненциальный множитель; ∆Н° – энтальпия (теплота) растворения кислорода в воде (∆Н° <0 ).
– предэкспоненциальный множитель; ∆Н° – энтальпия (теплота) растворения кислорода в воде (∆Н° <0 ).
Сочетание этих двух факторов ( 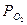 и T) при нагреве воды до температуры кипения, когда давление паров воды достигает атмосферного, а парциальное давление кислорода над раствором снижается практически до нуля, обеспечивает эффективную деаэрацию коррозионной среды.
и T) при нагреве воды до температуры кипения, когда давление паров воды достигает атмосферного, а парциальное давление кислорода над раствором снижается практически до нуля, обеспечивает эффективную деаэрацию коррозионной среды.
Скорость процесса деаэрации определяется уравнением:
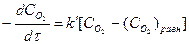 , (5.7)
, (5.7)
где: 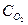 - текущая концентрация кислорода в деаэрируемой воде в данный момент времени τ; k/ =1/kS – константа скорости деаэрации, включающая в себя коэффициент пропорциональности k и удельную поверхность раздела фаз S на границе «вода-пар»; (
- текущая концентрация кислорода в деаэрируемой воде в данный момент времени τ; k/ =1/kS – константа скорости деаэрации, включающая в себя коэффициент пропорциональности k и удельную поверхность раздела фаз S на границе «вода-пар»; ( 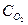 )равн – равновесная концентрация кислорода, cooтветствующая парциальному давлению при данной температуре.
)равн – равновесная концентрация кислорода, cooтветствующая парциальному давлению при данной температуре.
При температуре кипения Р 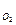 ≈ 0, следовательно, и (С
≈ 0, следовательно, и (С 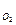 )равн ≈ 0. Тогда уравнение (5.7) будет иметь вид:
)равн ≈ 0. Тогда уравнение (5.7) будет иметь вид:
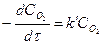 . (5.8)
. (5.8)
Интегрирование этого уравнения приводят к выражению
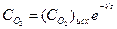 , (5.9)
, (5.9)
где: (С 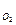 )исх - концентрация кислорода в воде в момент начала деаэрации при заданной температуре и парциальном давлении кислорода над раствором.
)исх - концентрация кислорода в воде в момент начала деаэрации при заданной температуре и парциальном давлении кислорода над раствором.
Площадь межфазной поверхности, входящая в k/, в процессе кипячения может меняться, поэтому при использовании уравнения (5.9) для расчетов необходимо знать зависимость этой величины от времени.
При десорбционном способе деаэрация воды достигается интенсивным перемешиванием ее газом с очень низким содержанием кислорода. В результате диффузионного перераспределения кислорода между раствором и продуваемым газом, концентрация его в воде снижается до весьма малых значений. В соответствии о законом Генри и материальным балансом процесса, конечное содержание кислорода в деаэрируемой воде (С 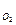 )кон, определяется его начальной концентрацией (С
)кон, определяется его начальной концентрацией (С 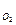 )нач константой Генри (КГ), cooтношением объемов деаэрируемой воды и вдуваемого газа Vв/Vг; константой k0, учитывающей отношение конечной концентрации О2 в воде и концентрацию кислорода (Сг) в газовой фазе:
)нач константой Генри (КГ), cooтношением объемов деаэрируемой воды и вдуваемого газа Vв/Vг; константой k0, учитывающей отношение конечной концентрации О2 в воде и концентрацию кислорода (Сг) в газовой фазе:
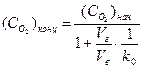 , (5.10)
, (5.10)
Высокая скорость процесса обеспечивается применением газо-водяного эжектора.
Химическое обескислороживание осуществляется введением в воду восстановителей - гидразина (N2H4), сульфита натрия или калия, сернистого газа, гидросульфита натрия и других веществ, связывающих кислород, растворенный в воде. Этот метод обычно применяется после предварительной термической деаэрации, удаляющей основную массу кислорода. При оценке необходимого количества восстановителей рассматриваются соответствующие реакции кислорода с ним, например:
2Na2SO3 +О2 =2Na2SO4, (5.11)
N2H4·H2O+O2=N2+3H2O, (5.12)
2Na2S2O4+4NaOH+3O2=4Na2SO4+2H2O. (5.13)
Так, при химическом обескислороживании воды по реакции (5.11) концентрация сернистого натрия pacчитываeтcя из соотношения:
Q= 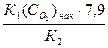 (г/м3), (5.14)
(г/м3), (5.14)
где K1 - коэффициент избытка Na2SO3, равный 1,1-1,25; (С 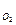 ) нач – содержание кислорода в деаэрируемой воде, мг/л; коэффициент 7,9 - теоретический расход безводного сульфита натрия в мг на мг связываемого кислорода; K2 - доля химически чистого сульфита натрия в техническом сульфите (Na2SO3·7H2О).
) нач – содержание кислорода в деаэрируемой воде, мг/л; коэффициент 7,9 - теоретический расход безводного сульфита натрия в мг на мг связываемого кислорода; K2 - доля химически чистого сульфита натрия в техническом сульфите (Na2SO3·7H2О).
Дата добавления: 2017-02-13; просмотров: 1545;











