Цитохромы Р450. Структура и функция
Метаболизм чужеродных соединений
Биотрансформации ксенобиотиков представляет собой принципиальный механизм поддержания гомеостаза во время воздействия на организм чужеродных соединений. В системе биотрансформации принято выделять две фазы метаболизма . К 1-й фазе относятся реакции гидролиза, восстановления и окисления субстрата. Обычно они приводят к внедрению или образованию функциональной группы типа –OH, -NH2, -SH, -COOH, что несколько увеличивает гидрофильность исходного соединения.Ферменты 1-й фазы метаболизма ксенобиотиков
Цитохромы Р450. Структура и функция
Среди ферментов 1-й фазы ведущее место занимает система цитохрома Р450 (P450 или CYP) с точки зрения каталитической активности в отношении огромного числа ксенобиотиков. Наибольшая концентрация цитохрома Р450 обнаруживается в эндоплазматическом ретикулуме гепатоцитов (микросомах). Печеночные микросомальные цитохромы Р450 играют важнейшую роль в определении интенсивности и времени действия чужеродных соединений и ключевую - в детоксикации ксенобиотиков, а также в активации их до токсичных и/или канцерогенных метаболитов. Цитохрома Р450-зависимые монооксигеназы – мультиферментная электрон-транспортная система. Все цитохромы Р450 - гемсодержащие белки. Обычно гемовое железо находится в окисленном состоянии (Fe3+). Восстанавливаясь до состояния Fe2+, цитохром Р450 способен связывать лиганды, такие как кислород или монооксид углерода. Комплекс восстановленного цитохрома Р450 с СО имеет максимум поглощения 450 nм, что и явилось основанием для названия этих ферментов. Основная реакция, которую катализируют цитохромы Р450 – монооксигеназная, в которой один атом кислорода взаимодействует с субстратом (RH), а другой восстанавливается до Н2О. В качестве восстановителя в реакции участвует НАДФН: RH (субстрат)+О2 + НАДФH + H+ --> ROH (продукт) + Н2О + НАДФ+ Механизм, благодаря которому цитохром получает электрон от НАДФH, зависит от внутриклеточной локализации цитохрома Р450. В ЭПР, где расположено большинство гемопротеидов, участвующих в биотрансформации ксенобиотиков, электрон передается через флавопротеин, называемый НАДФH-Р450 редуктаза. Одна молекула редуктазы может доставлять электроны на несколько различных молекул Р450. В митохондриях, где расположены итохромы Р450, участвующие в биосинтезе стероидных гормонов и метаболизме витамина D, электрон переносится с помощью 2-х белков: ферродоксина или ферродоксин-редуктазы. На рис. 1 показан каталитический цикл цитохрома Р450. 1-я часть цикла заключается в активации кислорода, 2-я – в окислении субстрата. Схема действия микросомальной монооксигеназной системы впервые была описана Эстабруком с соавт., в настоящее время она подтверждена многими исследователями. Эта схема такова: первая стадия состоит во взаимодействии субстрата с окисленной формой Р450. При связывании Р450 с субстратами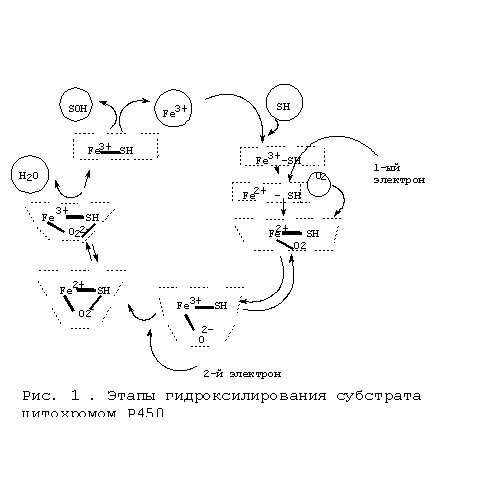 происходит переход гемового железа из низкоспинового в высокоспиновое состояние. Вторая стадия состоит в восстановлении образовавшегося фермент-субстратного комплекса первым электроном, который поступает с НАДФН-специфичной цепи переноса от НАДФН через флавопротеид I (НАДФН-цитохром Р450 редуктазу). Третья стадия состоит в образовании тройного комплекса: восстановленный цитохрома Р450-субстрат-кислород. Четвертая стадия представляет собой восстановление тройного комплекса вторым электроном, который, как полагают, поступает из НАДН-специфичной цепи переноса электронов, состоящей из НАДН-цитохром b5 редуктазы или флавопротеида II и цитохрома b5 . Пятая стадия состоит из нескольких процессов, включающих внутримолекулярные превращения восстановленного тройного комплекса и его распад с образованием гидроксилированного продукта и воды. На этой стадии цитохром Р450 переходит в исходную окисленную форму.
происходит переход гемового железа из низкоспинового в высокоспиновое состояние. Вторая стадия состоит в восстановлении образовавшегося фермент-субстратного комплекса первым электроном, который поступает с НАДФН-специфичной цепи переноса от НАДФН через флавопротеид I (НАДФН-цитохром Р450 редуктазу). Третья стадия состоит в образовании тройного комплекса: восстановленный цитохрома Р450-субстрат-кислород. Четвертая стадия представляет собой восстановление тройного комплекса вторым электроном, который, как полагают, поступает из НАДН-специфичной цепи переноса электронов, состоящей из НАДН-цитохром b5 редуктазы или флавопротеида II и цитохрома b5 . Пятая стадия состоит из нескольких процессов, включающих внутримолекулярные превращения восстановленного тройного комплекса и его распад с образованием гидроксилированного продукта и воды. На этой стадии цитохром Р450 переходит в исходную окисленную форму. 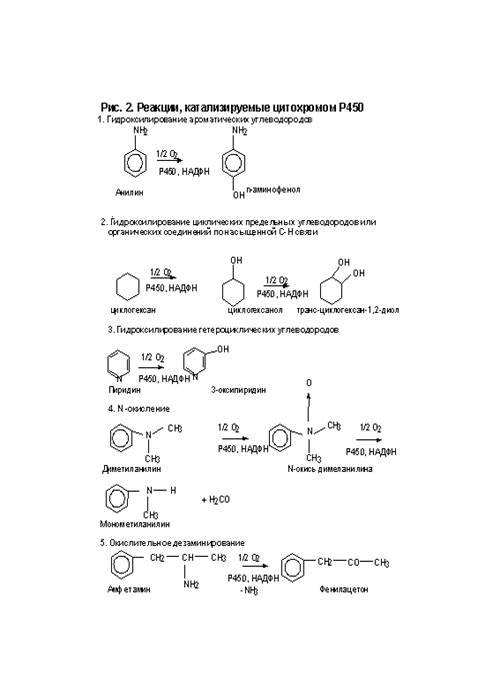 Цитохромы Р450 катализируют следующие типы реакций: гидроксилирование алифатического или ароматического атома углерода; эпоксидирование двойной связи; окисление атома (S, N, I) или N-гидроксилирование; перенос окисленной группы; разрушение эфирной связи; дегидрогенирование. Некоторые реакции, катализируемые цитохромом Р450, представлены на рис. 2 и 3. Несколько классов реагентов хорошо иллюстрируют реакции фазы 1. Например, алканы гидроксилируются цитохромом Р450. Обычно гидроксилируется последний углерод в цепи, так называемое омега- гидроксилирование. Так же бывает внутреннее гидроксилирование в нескольких позициях (позиции -1,- 2).
Цитохромы Р450 катализируют следующие типы реакций: гидроксилирование алифатического или ароматического атома углерода; эпоксидирование двойной связи; окисление атома (S, N, I) или N-гидроксилирование; перенос окисленной группы; разрушение эфирной связи; дегидрогенирование. Некоторые реакции, катализируемые цитохромом Р450, представлены на рис. 2 и 3. Несколько классов реагентов хорошо иллюстрируют реакции фазы 1. Например, алканы гидроксилируются цитохромом Р450. Обычно гидроксилируется последний углерод в цепи, так называемое омега- гидроксилирование. Так же бывает внутреннее гидроксилирование в нескольких позициях (позиции -1,- 2). 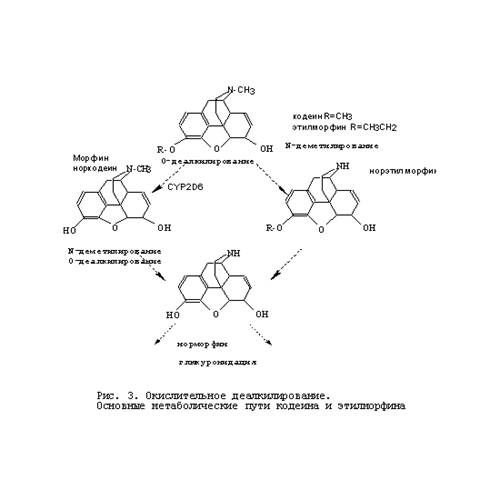 Это приводит к множеству различных вариантов продуктов даже с таким простым алканом, как гексан. Заметим, что циклические углеводороды тоже подвергаются гидроксилированию. В реакции гидроксилирования сначала образуется полуацеталь, который потом превращается в спирт и альдегид. При окислении алкенов цитохромом Р450 образуются двуатомные окиси. Они отличаются по своей стабильности и могут являться высоко реакционноспособными. Например, винилхлорид метаболически переходит в окись, которая затем превращается в хлорацетальдегид – мутаген, действующий непосредственно на ДНК. Эти исследования привели к запрету на использование винилхлорида в распылителях. Винильная группа стерина (винилбензол) известна своими канцерогенными свойствами, но организм человека способен нейтрализовать его, переводя окись с помощью фермента эпоксигидролазы в диол. Но эпоксигидролаза помогает не всегда. Например, цитохром Р450 синтезирует эпоксид Афлотоксина В1 in vivо. Это соединение – высоко реакционноспособный электрофил, не стабилен и быстро формирует аддукт с ДНК. К тому же диол, образующийся из эпоксида, так же нестабилен и высоко реакционноспособен. Окисление ароматических соединений цитохромом Р450 так же дает эпоксиды, но они быстро переходят в фенол. В результате гидроксилирования бензола, полученный фенол может опять гидроксилироваться, переходя в катехол или гидрохинон. Заметим, что катехол и гидрохинон могут реагировать с кислородом, подавляя аналогичные реакции с хинонами и супероксидами, которые являются токсинами. Такое известное соединение как 2,3,7,8-тетрахлордибензолдиоксин (ТХДД) не подвержен гидроксилированию и устойчив (период полураспада в организме человека – год и более).
Это приводит к множеству различных вариантов продуктов даже с таким простым алканом, как гексан. Заметим, что циклические углеводороды тоже подвергаются гидроксилированию. В реакции гидроксилирования сначала образуется полуацеталь, который потом превращается в спирт и альдегид. При окислении алкенов цитохромом Р450 образуются двуатомные окиси. Они отличаются по своей стабильности и могут являться высоко реакционноспособными. Например, винилхлорид метаболически переходит в окись, которая затем превращается в хлорацетальдегид – мутаген, действующий непосредственно на ДНК. Эти исследования привели к запрету на использование винилхлорида в распылителях. Винильная группа стерина (винилбензол) известна своими канцерогенными свойствами, но организм человека способен нейтрализовать его, переводя окись с помощью фермента эпоксигидролазы в диол. Но эпоксигидролаза помогает не всегда. Например, цитохром Р450 синтезирует эпоксид Афлотоксина В1 in vivо. Это соединение – высоко реакционноспособный электрофил, не стабилен и быстро формирует аддукт с ДНК. К тому же диол, образующийся из эпоксида, так же нестабилен и высоко реакционноспособен. Окисление ароматических соединений цитохромом Р450 так же дает эпоксиды, но они быстро переходят в фенол. В результате гидроксилирования бензола, полученный фенол может опять гидроксилироваться, переходя в катехол или гидрохинон. Заметим, что катехол и гидрохинон могут реагировать с кислородом, подавляя аналогичные реакции с хинонами и супероксидами, которые являются токсинами. Такое известное соединение как 2,3,7,8-тетрахлордибензолдиоксин (ТХДД) не подвержен гидроксилированию и устойчив (период полураспада в организме человека – год и более).
Дата добавления: 2019-09-30; просмотров: 782;











