Пример 2. Кинетика химических процессов
В общем случае скорость химической реакции зависит от концентрации реагирующих веществ. Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, влияющего на скорость, называется кинетическим дифференциальным уравнением химического процесса. Рассмотрим химические процессы первого порядка.
Скорость, реакции первого порядка выражается уравнением:
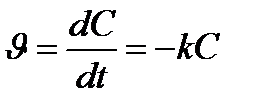 , (1)
, (1)
где C- концентрация реагирующего вещества: ;
k- постоянная скорости реакции.
Минус в уравнении (1) означает, что концентрация реагирующего вещества с течением времени убывает.
В дифференциальном уравнении (1) разделим переменные и проинтегрируем его:
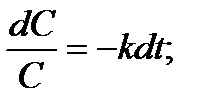
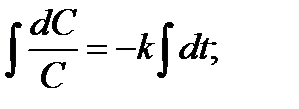
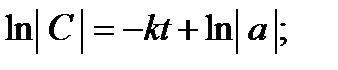
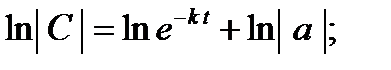
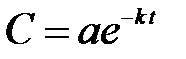 ,
,
где a- постоянная интегрирования.
Полагая при t=0, C=C0, получаем a=C0, следовательно,
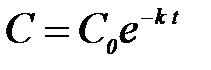 , (2)
, (2)
где С0 – начальная концентрация реагирующего вещества.
Рис 2. График изменения концентрации вещества, вступающего в реакцию, от времени.
Формула (2) выражает закон химической реакции первого порядка в интегральной форме. Пользуясь уравнением (2), можно определить время, за которое концентрация исходного вещества уменьшается на половину. Это время называют периодом полупревращения или полупериодом протекания реакции и обозначают t.
Подставив значения t=t, 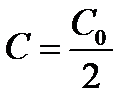 в уравнение (2), получим:
в уравнение (2), получим:
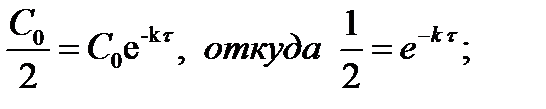
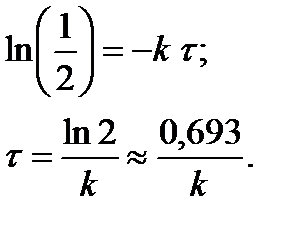
Таким образом, период полупревращения не зависит от исходной концентрации вещества, и за равные промежутки времени расходуется одна и та же доля вещества.
Дата добавления: 2016-06-05; просмотров: 2245;











