Свойства трифенилметана
Трифенилметан легко окисляется до трифенилкарбинола. Водородный атом в молекуле трифенилметана легко замещается на атомы металлов и галогенов. В свою очередь трифенилкарбинол при действии HCl образует трифенилхлорметан, который при восстановлении дает трифенилметан, а при гидролизе – трифенилкарбинол:
[O]
 (C6H5)3C – H (C6H5)3C – OH
(C6H5)3C – H (C6H5)3C – OH
 трифенилметан [H] трифенилкарбинол
трифенилметан [H] трифенилкарбинол
 |  |  |
Na Cl2 H2 HCl H2O
 (C6H5)3C – Na+ (C6H5)3Cδ+ Cl δ–
(C6H5)3C – Na+ (C6H5)3Cδ+ Cl δ–
трифенилметилнатрий трифенилхлорметан
Все эти данные свидетельствуют о том, что связь трифенилметильной группы с другими группами и атомами непрочная.
Причина подвижности атомов и групп атомов, соединенных с трифенилметильной группировкой, является особенно большая устойчивость образующихся в реакциях трифенилметильных радикалов или ионов.
 При растворении трифенилкарбинола в концентрированной серной кислоте образуется окрашенный раствор, в котором присутствует ион (С6Н5)3С+ - это явление галохромии. При разбавлении этого раствора выделяется неизменившийся трифенилкарбинол, то есть проявляются основные свойства карбинола (свойства основания):
При растворении трифенилкарбинола в концентрированной серной кислоте образуется окрашенный раствор, в котором присутствует ион (С6Н5)3С+ - это явление галохромии. При разбавлении этого раствора выделяется неизменившийся трифенилкарбинол, то есть проявляются основные свойства карбинола (свойства основания):
··


 (С6Н5)3С – ОН + Н+ (С6Н5)3С – О+Н2 (С6Н5)3С+ + Н2О
(С6Н5)3С – ОН + Н+ (С6Н5)3С – О+Н2 (С6Н5)3С+ + Н2О
трифенилкарбинол трифенилметилоксоний трифенилметил-ион
В 1901 году Гомберг получил углеводород С38Н30 действием металла на трифенилхлорметан. Этому соединению до последнего времени приписывалось строение гексафенилэтана (С6Н5)3С – С(С6Н5)3. В настоящее время установлено, что полученный димер имеет строение 1- дифенилметилен-4-трифенилметил-2,5-циклогексадиена:

 H
H



 2 (С6H5)3C – Cl + 2 Ag (или Zn) (C6H5)2C = + 2AgCl
2 (С6H5)3C – Cl + 2 Ag (или Zn) (C6H5)2C = + 2AgCl
C(C6H5)3
трифенилхлорметан 1-дифенилметилен-4-трифенилметил-
2,5-циклогексадиен
Димер трифенилметана – это бесцветное кристаллическое вещество, но растворы его имеют глубокую окраску желтого цвета. Такие растворы быстро поглощают кислород воздуха, образуя бесцветную перекись трифенилметила:




 Н
Н
 (С6Н5)2С = + О2 (С6Н5)3С – О – О – С(С6Н5)3
(С6Н5)2С = + О2 (С6Н5)3С – О – О – С(С6Н5)3
С(С6Н5)3
1-дифенилметилен-4-трифенилметан- перекись трифенилметила
2,5- циклогексадиен (желтый цвет) (бесцветный раствор)
Димер трифенилметана обесцвечивает раствор йода с образованием йодистого трифенилметила и реагирует с щелочными металлами, образуя кирпично-красные соли:




 Н
Н
 (С6Н5)2С = + J2 2 (С6Н5)3С – J
(С6Н5)2С = + J2 2 (С6Н5)3С – J
С(С6Н5)3
1-дифенилметилен-4-трифенилметан- йодистый трифенилметил
2,5- циклогексадиен (желтый цвет) (бесцветный раствор)




 Н
Н
 (С6Н5)2С = + 2К 2 (С6Н5)3С – К+
(С6Н5)2С = + 2К 2 (С6Н5)3С – К+
С(С6Н5)3
1-дифенилметилен-4-трифенилметан- трифенилметил калий
2,5- циклогексадиен (желтый цвет) (кирпично-красный раствор)
Все эти явления объясняются тем, что димер частично диссоциирует в растворах на два свободных трифенилметильных радикала, каждый из которых имеет неспаренный электрон:




 Н
Н
 (С6Н5)2С = 2 (С6Н5)3С •
(С6Н5)2С = 2 (С6Н5)3С •
С(С6Н5)3
Наличие неспаренного электрона позволяет радикалам присоединять либо молекулу кислорода, либо атом йода с образованием ковалентной связи. Они могут также присоединять электроны от атомов металла с образованием ионной связи.
Радикалы имеют постоянный магнитный момент.
Устойчивость свободных радикалов связана с возможностью распределения электронного облака между большим числом углеродных атомов трех бензольных колец, то есть происходит делокализация электронной плотности между тремя бензольными кольцами. Неспаренный электрон метанового углерода вступает в р-π – сопряжение с электронами бензольных ядер, что снижает ненасыщенность каждого углеродного атома всего радикала. Такие устойчивые сопряженные радикалы могут быть конечными продуктами реакции. Подобное сопряжение отсутствует у радикалов жирного ряда, в которых неспаренный электрон локализован на углеродном атоме, вследствие чего эти радикалы неустойчивы и являются химически очень активными, то есть вступают в дальнейшие химические реакции.
Трифенилметан построен неплоско. Бензольные ядра вследствие перекрывания водородных атомов несколько взаимно повернуты (на 200 – 300), как лопасти пропеллера:
 |  |




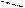

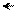
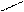
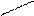

 •
•





 С или С
С или С


Диссоциация димеров триарилметильных радикалов увеличивается при введении в пара-положение как электронодонорных, так и электроноакцепторных заместителей, так как они способствуют лучшему рассредоточению неспаренного электрона.
Трифенилметильные радикалы окрашены в фиолетовый цвет.
Изменение условий реагирования трифенилхлорметана воздействием на него апротонных кислот, растворенных в сильных протонных кислотах (AlCl3 – H2SO4, SbF5 – HOSO2F) приводит к гетеролитическому разрыву связи С – Г и образованию в растворе долгоживущего трифенилметильного катиона (тритильного катиона). В нем положительный заряд делокализован р-π –сопряжением с тремя бензольными кольцами, причем смещение электронных плотностей идет от колец к карбокатиону. В условиях металлоорганического синтеза при действии на трифенилхлорметан амальгамой натрия в эфире образуется трифенилметилнатрий – ионное соединение, в котором отрицательный заряд на карбоанионе делокализован сопряжением с тремя бензольными кольцами (смещение электронных плотностей идет от аниона в кольца):
 | |||||||
 | |||||||
 | 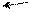 | ||||||

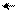


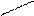

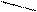

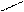




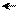



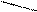

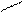








 + Cl
+ Cl

 C AlCl4, H2SO4 C NamHgn C
C AlCl4, H2SO4 C NamHgn C
трифенилметильный катион трифенилхлорметан трифенилметильный анион
(оранжево-желтый цвет) (красный цвет)
Дата добавления: 2017-01-16; просмотров: 3455;











