Нитросоединения ароматического ряда
Реакция нитрования – это замещение атомов водорода в ароматических соединениях нитрогруппой (-NO2). Нитрогруппа может быть в кольце, например,
С6Н5 – NO2 – нитробензол или (о-, м-, п-) – нитротолуол CH3 – C6H4 – NO2, а может быть в боковой цепи, например C6H5 – CH2 – NO2 – фенилнитрометан.
Нитросоединения являются полупроводниками в синтезе красителей, применяются как взрывчатые вещества, растворители, пахучие вещества и так далее.
Нитрующими реагентами являются:
1) смесь концентрированной азотной кислоты (d 1,48 – 1,52) г/мл и концентрированной серной кислоты (d 1,84) г/мл;
2) концентрированная азотная кислота в избытке. Недостаток этого реагента – побочные реакции окисления;
3) Раствор нитрата калия (КNO3) в серной кислоте – жесткие условия нитрования;
4) Оксид азота (IV) (NO2) в смеси с пиридином и диоксаном.
Из всех нитрующих реагентов активным агентом является ион нитрония NO2+, который получается следующим образом:
 NO2 – OH + 2 H – SO4H NO2+ + H3O+ + 2 HSO4–
NO2 – OH + 2 H – SO4H NO2+ + H3O+ + 2 HSO4–
(HNO3) (H2SO4)
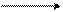 2 HNO3 NO2+ + NO3– + H2O
2 HNO3 NO2+ + NO3– + H2O
Реакция нитрования идет по механизмуSЕ2. Она включает стадию образования π-комплекса, медленно превращающегося в σ-комплекс, который быстро стабилизируется в продукт реакции:




 O2N H NO2
O2N H NO2

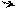

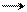



 HNO3+H2SO4 NO2+ HSO4–
HNO3+H2SO4 NO2+ HSO4–



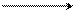
 + NO2+ медленно + быстро + H2SO4
+ NO2+ медленно + быстро + H2SO4
π-комплекс σ-комплекс нитробензол
Нитрующим агентом может быть и ион нитрозония (N=O)+ или NO+, при этом полученное нитрозосоединение окисляется до нитропродукта.
Дата добавления: 2017-01-16; просмотров: 1791;











