Динамический подход
Решающим фактором, определяющим направление электрофильного замещения, является влияние заместителя на устойчивость образующегося σ-косплекса.
Вообще, замещение идет в любое положение кольца, однако с различной скоростью, определяемой энергией активации. Энергия активации тем меньше, а скорость реакции тем больше, чем выше устойчивость σ-косплекса, то есть чем меньше энергии требуется для возникновения соответствующего переходного состояния. Главным фактором стабильности соединений является сопряжение. Соединение будет тем устойчивее, чем это сопряжение будет больше. Анализируется также характер распределения электронной плотности в σ-косплексе с учетом того, что размещение одноименных зарядов у рядом стоящих атомов требует затраты большей энергии и, следовательно, является дестабилизирующим фактором.
Энергетическая диаграмма реакции SE2

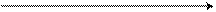
 Е
Е
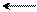 мета-положение (замещение)
мета-положение (замещение)

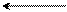
 орто-положение
орто-положение
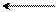 пара-положение
пара-положение
координата реакции
Энергетическая диаграмма показывает изменение энергии в ходе реакции SE2.
Энергия σ-комплексов понижается, а их стабильность возрастает в ряду:
м-замещение > о-замещение > п-замещение
Следовательно, у ароматических соединений, содержащих электронодонорные заместители, электрофильные реагенты вступают в о- и п- положения.
При электрофильном замещении заместители 1-ого рода повышают стабильность σ-косплексов о- и п-ориентации. Например, галогенирование анилина:





 о-замещение NH2 ׃ NH2 ׃ NH2 NH2+
о-замещение NH2 ׃ NH2 ׃ NH2 NH2+















 sp3Br +1/ 3 Br + Br Br
sp3Br +1/ 3 Br + Br Br



 + H H H H
+ H H H H

 +1/ 3 +1/ 3
+1/ 3 +1/ 3
устойчив

 NH2 NH2
NH2 NH2








 NH2 Br Br
NH2 Br Br
 SE2 H H
SE2 H H




 + Br+ + +
+ Br+ + +






 п-замещение NH2 ׃ NH2 ׃ NH2 NH2+ NH2 NH2
п-замещение NH2 ׃ NH2 ׃ NH2 NH2+ NH2 NH2










 +1/ 3 +
+1/ 3 +





 +
+
+1/ 3 +1/ 3 + +











 H Br H Br H Br H Br H Br H Br
H Br H Br H Br H Br H Br H Br
 устойчив
устойчив

 м-замещение NH2 ׃ NH2
м-замещение NH2 ׃ NH2

 +1/ 3 – +1/ 3
+1/ 3 – +1/ 3

 + H H
+ H H

 Br Br
Br Br
+1/ 3 неустойчив
Из схемы видно, что электрофил, атакуя бензольное кольцо, вытягивает из ароматического секстета пару электронов и привязывается этой парой к атакуемому атому углерода, сохраняющему в переходном состоянии и в σ-комплексе связь и с атомом водорода. Атакованный атом углерода в σ-комплексе становится тетраэдрическим, а оставшиеся 4 π-электрона располагаются в виде двух сопряженных двойных связей в кольце. Вследствие оттягивания пары электронов на соседнем атоме углерода возникает положительный заряд. Этот положительный заряд частично нейтрализуется в том случае, если этот заряд находится на атоме углерода, несущем орто- или пара-ориентант, и что атаке подвергается углеродный атом в орто- или пара-положении по отношению к углероду, несущему ориентант. Если на ориентанте имеется неподеленная электронная пара, то он передает её в совместное обладание связанному с ним углероду бензольного ядра, устанавливая с ним двойную связь и переходя в результате в положительно заряженное аммониевое состояние.
В случае мета-замещения в σ-комплексе нет сопряжения, и такой σ-комплекс – неустойчив. К тому же, на атоме углерода, несущем заместитель в σ-комплексе, возникает отрицательный заряд (альтернирующий эффект), и получается, что рядом находятся два одноименных заряда, которые отталкиваются друг от друга. (см.схему).
Алкилы компенсируют положительные заряды в σ-комплексе за счет своего положительного индуктивного эффекта. Сравнивая реакции замещения SE бензола и толуола, можно видеть большие скорости реакции в случае толуола, так как σ-комплекс у толуола энергетически более выгоден, чем у бензола:

 СН3 Н
СН3 Н



 + Н + H
+ Н + H





 Br Br
Br Br
+I (СН3) I(Н)=0,
компенсирует положительный не компенсируется положительный
заряд ядра заряд ядра
При наличии в бензольном кольце заместителя 2-ого рода сопряжения с этим заместителем в σ-комплексе не возможно, так как эти заместители не могут отдавать электроны для компенсации положительного заряда ядра. σ-Комплекс энергетически выгодным будет тот, при образовании которого не появляются два положительных заряда на рядом стоящих атомах.
Например, электрофильное замещение нитробензола:






 о-замещениеO – N+ = O O – N+= O O – N+= O
о-замещениеO – N+ = O O – N+= O O – N+= O









 H +1/ 3 H + H
H +1/ 3 H + H


 + Br Br Br
+ Br Br Br


 O – N+ = O +1/ 3 +1/ 3
O – N+ = O +1/ 3 +1/ 3

 неустойчив
неустойчив










 + Br+ O – N+= O O – N+= O O–N+=O O–N+=O O–N+=O
+ Br+ O – N+= O O – N+= O O–N+=O O–N+=O O–N+=O








 м-замещение +1/ 3 – +1/ 3 + +
м-замещение +1/ 3 – +1/ 3 + +







 + H H H H H
+ H H H H H





 Br Br Br Br Br
Br Br Br Br Br
+1/ 3 +
 устойчив
устойчив



 O–N+=O O–N+=O
O–N+=O O–N+=O


 +1/ 3
+1/ 3
 п-замещение +
п-замещение +
 +1/ 3 +1/ 3
+1/ 3 +1/ 3



 H Br H Br неустойчив
H Br H Br неустойчив
Из схемы видно, что σ-комплексы при орто- и пара-замещении неустойчивы, так как и на заместителе, и на рядом стоящем с заместителем атомах углерода кольца находятся положительные заряды, которые взаимно отталкиваются, что энергетически не выгодно.
В случае σ-комплекса при мета-замещении на атоме азота заместителя и на атоме углерода кольца при заместителе находятся разноименные заряды, которые притягиваются друг к другу, что делает такой σ-комплекс энергетически устойчивым.
Таким образом, электронные эффекты облегчают или затрудняют взаимодействие реагентов с определенными атомами в бензольном кольце, изменяя устойчивость промежуточного σ-комплекса.
При удалении заместителя, находящегося в боковой цепи, его ориентирующее влияние быстро ослабевает. Например, при нитровании нитробензола, фенилнитрометана и фенилнитроэтана выход мета-замещенного продукта уменьшается:


 NO2 CH2 – NO2 CH2 – CH2 – NO2
NO2 CH2 – NO2 CH2 – CH2 – NO2
 |  |  |


 NO2 NO2 NO2
NO2 NO2 NO2
93% 48% 13%
Интересен вопрос о соотношении о- и п- изомеров.
Во-первых, имеется два орто-положения и одно пара-положение в бензольном ядре. Во-вторых, в орто-положении могут иметь место пространственные затруднения, например, нитрование п-цимола:

 CH3 CH3
CH3 CH3


 NO2
NO2

 + HNO3 + H2O
+ HNO3 + H2O
 |  |
CH3 – CH – CH3 CH3 – CH – CH3
1-метил-4-изопропилбензол 1-метил-2-нитр-4-изопропилбензол
В- третьих, имеет место индуктивное влияние, которому подвергаются особенно орто-положения, потому что индуктивный эффект с возрастанием цепи затухает, и на мета- и пара-положения бензольного кольца индуктивный эффект действует минимально.
Если заместитель дезактивирует ядро, то эта дезактивация будет сильнее проявляться в орто-положении. Например, хлорирование хлорбензола:
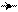
 ׃ Cl Cl
׃ Cl Cl
 | |||
 | |||


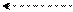



 δ – + + δ – + Cl+ + H+
δ – + + δ – + Cl+ + H+
 |  |

 + δ –
+ δ –
Cl
п-дихлорбензол
У хлорбензола вследствие сильного отрицательного индуктивного эффекта в о- и п-положении появляются положительные заряды, которые больше в о-положении, чем в п-положении кольца (индуктивный эффект с ростом цепи затухает). Но мезомерный эффект в виде р-π-сопряжения, как ориентирующий эффект, способствует возникновению частичных отрицательных зарядов в тех же положениях кольца (орто- и пара-). Электрофил (катион хлора), как реагент, притягивается к отрицательным зарядам субстрата, находит меньше сопротивления одноименным зарядам в пара-положении по сравнению с орто-положением. Отсюда, образуется максимальное количество пара-замещенных продуктов реакции.
В- четвертых, эффект сопряжения более всего проявляется в п-положении.
Наибольшее значение имеет эффект сопряжения в устойчивости σ-комплекса, но этот эффект существует только в том случае, если вся молекула копланарная. Если оси облаков р-электронов заместителя и р-электронов бензольного кольца не являются параллельными, сопряжение ослабляется, и заместитель теряет свое влияние на бензольное ядро.
Например, в молекуле п-нитрохлорбензоле атом хлора очень подвижен благодаря сопряжению нитро-группы с кольцом. Если в орто-положения кольца по отношению к атому хлора ввести метильные группы, то и в этом случае копланарность системы не нарушается, и нитро-группа находится в сопряжении с бензольным кольцом, влияя на подвижность атома хлора. В случае введения метильных групп в орто-положения по отношению к нитро-группе, последняя выводится из копланарной системы объемными метилами, сопряжение нитро-группы с бензольным ядром исчезает, и атом хлора перестает быть подвижным:
 |  |  |




 Cl Cl Cl
Cl Cl Cl





 H3C CH3
H3C CH3







 H3C CH3
H3C CH3
 |  |

 NO2 NO2 O N
NO2 NO2 O N
 |  |  |
Дата добавления: 2017-01-16; просмотров: 1752;











