Скорость химической реакции
Изучение скоростей реакции позволяет выяснить истинный механизм протекания сложных химических превращений. Это в свою очередь создает перспективы для нахождения путей управления химическим процессом, т.е. его скоростью и направлением. Выяснение кинетики реакций позволяет осуществить математическое моделирование реакций, происходящих в химических аппаратах, и с помощью электронно-вычислительной техники решать задачи оптимизации и автоматизации химико-технологических процессов.
Реакции могут быть гомогенными и гетерогенными. Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком растворе). Гетерогенные реакции протекают в неоднородной среде – между веществами, которые находятся в разных фазах (твердой и жидкой, газовой и жидкой и т.д.). Таким образом, гомогенные реакции происходят равномерно во всем объеме, заполненном реагентами, гетерогенные — только на некоторых пограничных поверхностях — на границе раздела фаз. Примером гетерогенной реакции может служить реакция между веществом в газовой фазе и поверхностью жидкого или твердого тела.
Скоростью реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (в случае гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенной реакции). Скорость реакции обычно характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в единицу времени и чаще всего выражают в моль/см3*мин.
О скорости реакции можно судить также по скорости изменения какого-либо свойства системы, например, окраски, электрической проводимости, давления, спектра и т.д.
Если в момент времени τ1 и τ2 концентрации одного из исходных веществ равны с1 и с2, то среднюю скорость υ в интервале времени τ1 и τ2 можно выразить как:
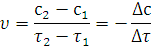
Поскольку речь идет об убыли концентрации исходного вещества, изменение концентрации в этом случае берется со знаком минус.
В ходе химических процессов концентрации веществ меняются непрерывно. Поэтому важно знать скорость реакции в данный момент времени, т.е. мгновенную скорость реакции. Последняя выражается первой производной концентрации по времени:
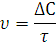
Если скорость реакции оценивается увеличением концентрации одного из продуктов реакции, то производная берется со знаком плюс.
Скорость химических превращений зависит от природы реагирующих веществ, их концентраций и внешних условий.
Скорость гомогенных реакций зависит от концентрации реагирующих веществ. Скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрическим коэффициентом.
Указанная закономерность называется законом действующих масс(Гульдберг и Вааге).
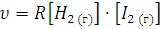 Для двухмолекулярной реакции взаимодействия водорода и йода Н2(г)+I2(г)=2НI(г) закон действующих масс выражается в виде следующего кинетического уравнения: ,
Для двухмолекулярной реакции взаимодействия водорода и йода Н2(г)+I2(г)=2НI(г) закон действующих масс выражается в виде следующего кинетического уравнения: ,
где υ-скорость реакции; [Н2] и [I2] – концентрации соответственно Н2 и I2. Кинетическое уравнение для трехмолекулярной реакции 2NO(г) + Cl2(г) = 2NOCl (г) будет 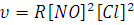
Коэффициент пропорциональности R называется константой скорости реакции. Величина R численно равна скорости реакции, когда концентрации реагирующих веществ равны единице. Константа скорости реакции зависит от: 1)природы реагирующих веществ; 2)температуры; 3)давления; 4)концентрации; 5)катализаторов.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому

где υt - скорость реакции при температуре t2, до которой нагревалась или охлаждалась система; υн – скорость реакции при начальной температуре t1; ∆t=t2-t1 и γ – температурный коэффициент, т.е. число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10о. Значения γ при обычных температурах лежат в пределах 2-4 для большинства реакций.
Увеличение скорости реакции с повышением температуры объясняется увеличением числа так называемых активных молекул, т.е. молекул, обладающих достаточной энергией для осуществления химического взаимодействия при их столкновении. Та минимальная избыточная энергия по сравнению со средней энергией, которой должны обладать молекулы, чтобы реакция между ними стала возможной, называется энергией активации Еа.
Разница между средней энергией молекул продуктов реакций и молекул исходных веществ (Ек-Ен) определяют тепловой эффект реакции 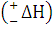 . Если Ек<Ен, то процесс будет экзотермическим, а если Ек>Ен, то процесс будет экзотермическим, а если Ек>Ен, то эндотермическим.
. Если Ек<Ен, то процесс будет экзотермическим, а если Ек>Ен, то процесс будет экзотермическим, а если Ек>Ен, то эндотермическим.
4.2.2. Физические методы стимулирования химических превращений
В связи с поисками новых путей проведения процессов в химической технологии разрабатываются методы направленного регулирования реакционной способности веществ и весьма интенсивно изучаются процессы, протекающие при различных физических воздействиях на вещество. Кроме нагревания на реакционную способность веществ существенное влияние оказывают свет, ионизирующие излучения, давление, механическое воздействие и др.
Воздействие света (видимого, ультрафиолетового) на реакции изучает особый раздел химии — фотохимия. Фотохимические процессы весьма разнообразны. К ним относятся некоторые реакции синтеза (хлорида водорода, органических веществ в растениях); разложения (перекиси водорода, светочувствительных материалов) и др. Фотохимическое действие света заключается в том, что молекулы реагирующих веществ, поглощая кванты света, возбуждаются, т.е. становятся реакционноспособными или распадаются на ионы и свободные радикалы.
Существенно новым способом воздействия на вещество является использование лазерного излучения. Его действие может быть фотохимическим и чисто термическим. Лазерное излучение обладает рядом уникальных свойств, которых лишены обычные источники света. Наиболее важным его свойством, с точки зрения применения для фотохимического инициирования химических реакций, является извлечение мощных потоков световой энергии в узких спектральных интервалах. Поэтому, используя излучение определенной длины волны, поглощаемое реагентом, но не поглощаемое примесями, можно осуществить избирательную реакцию.
Рентгеновские лучи, альфа-частицы, гамма-лучи, нейтроны и другие излучения большой энергии вызывают в веществе глубокие физико-химические изменения и инициируют разнообразные реакции. Так, при действии ионизирующих излучений на кислород образуется озон, алмаз превращается в графит, оксиды марганца выделяют кислород и т.д. При действии ионизирующих излучений на воду происходит ее радиолиз.
Химические процессы, происходящие под действием ионизирующих излучений, изучает радиационная химия. Радиационно-химические реакции используются для синтеза высокомолекулярных органических веществ и для изменения их структуры. По мере освоения атомной энергетики радиационная химия все шире проникает в химическую промышленность.
Химические превращения, происходящие под действием механических сил, изучает механохимия. Элементарным механохимическим актом является разрыв химических связей в веществе под действием механических сил (вальцевание, дробление, перетирание и др.).
Еще более сильные изменения претерпевают вещества под действием сверхвысоких давлений (порядка десятков тысяч атмосфер). Пример тому — образование более плотных и более твердых модификаций вещества, например превращение графита в алмаз.
Большое развитие получила химия ударного сжатия. При сжатии твердых тел и жидкостей ударными волнами, образуемыми, например, детонацией взрывчатых веществ, при взрывах, в миллионные доли секунды развиваются в веществе давления в десятки и сотни атмосфер, скачком изменяются плотность и температура вещества. При этом образуются активные частицы как радикального, так и ионного типов. Последствия прохождения через вещество ударной волны могут быть самыми различными. Взрыв, с одной стороны, вызывает раздробление вещества, распад сложного вещества на относительно более простые. Но возможно и обратное превращение – образование из простых молекул более сложных и длинных полимерных цепей [4].
Катализ
Одним из наиболее распространенных в химической практике методов ускорения химических реакций является катализ. В присутствии катализаторов изменяется путь, по которому проходит суммарная реакция, а потому изменяется ее скорость. Катализаторы — это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав. Увеличение скорости катализируемой реакции связано с меньшей энергией активации нового пути реакции.
Изменение скорости катализируемой реакции за с чет снижения энергии активации ее отдельных стадий можно рассмотреть на следующем примере. Допустим, между веществами А и В возможно взаимодействие с образованием соединения АВ (∆G < 0):
А + В → А...В → АВ
Но в силу высокой энергии активации эта реакция протекает с очень малой, практически равной нулю скоростью. Пусть, найдено такое третье вещество К (катализатор), которое легко вступает во взаимодействие с А (в силу другой природы реагирующих веществ, а следовательно, другой, меньшей, энергии активации), образуя соединение АК:
А + К → А...К → АК
Соединение же АК легко взаимодействует с веществом В (опять-таки в силу иной природы веществ и малой энергии активации), образуя вещества АВ и К:
В + АК → В...АК → АВ + К
Суммируя два последних уравнения, получим А + В = АВ т.е. в результате реакции катализатор остался без изменения.
Пример 1. Вычисление скорости реакции по концентрациям реагирующих веществ.
Реакция между веществами А и В протекает по уравнению 2А+В=С; концентрация вещества А равна 6 моль∙л-1, а вещества В-5 моль∙л-1. Константа скорости реакции равна 0,5л2∙моль-2 с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной системе останется 45% вещества В.
Решение. Скорость химической реакции выражается уравнением υ=k[A]2[B]. Скорость химической реакции в начальный момент равна υ1=0,5∙62∙5=90,0 моль∙с-1∙л-1. Через некоторое время в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет 5∙0,45=2,25моль∙л-1. Следовательно, концентрация вещества В уменьшилась на 5,0-2,25=2,75 моль∙л-1, а концентрация вещества А уменьшилась на 5,5 моль∙л-1 и стала равной 0,5моль∙л-1 (6-5,5). Отсюда υ2=0,5∙(0,5)2∙2,25=0,28 моль∙с-1∙л-1.
Пример 2. Влияние давления на скорости реакции.
Определите, как изменится скорость прямой реакции 2СО+О2=2СО2, если общее давление в системе увеличить в 4 раза.
Решение. При увеличении давления в 4 раза объем системы уменьшится в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Тогда υ1=k[CO]2[O2], а υ2= k[4CO]2[4O2]; 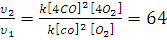
Дата добавления: 2019-09-30; просмотров: 537;











