Отряд Diplomonadida
Простейшие этого отряда обладают двойным набором всех органоидов и характеризуются билатеральной симметрией.
Они имеют 2 ядра, некоторые свободноживущие - 2 цитостома. Происхождение этих жгутиконосцев, видимо, связано с не доведенным до конца продольным делением.
Из числа паразитических дипломонад наибольший интерес представляет род Lamblia. Известно около 40 видов лямблий - паразитов млекопитающих: собак, кошек, волков, белок, мышей и др., включая человека. Лямблии имеют характерную грушевидную форму с расширенным передним и суженным задним концом. Спинная сторона тела выпуклая, на брюшинной стороне отчетливо видна впадина - присасывательный диск, ограниченный опорными фибриллами. Это органоид прикрепления к поверхности кишечника.
Лямблия кишечная(Lamblia intestinalis) - возбудитель лямблиоза.
Этиология. Лямблии (L. intestinalis) - представители одной из ранних ветвей филогенетического дерева эукариотов, но имеют особенности, свойственные прокариотам (отсутствие митохондрий, интронов в генах и др.).
Этот возбудитель впервые был обнаружен в фекалиях человека, больного диареей, и описан Антони ван Левенгуком в 1684 г.; в 1859 г. его подробно описал Д. Ф. Лямбль, который наблюдал этого представителя жгутиковых простейших в фекалиях детей с диареей в клинике Праги.
Лямблия по форме напоминает грушу, разрезанную пополам, имеет тело длиной 10-18 мкм, 2 ядра и 4 пары жгутиков. По средней линии вдоль всего тела проходят два тонких аксостиля. В расширенной части тела расположены два присасывательных диска, с помощью которых паразит прикрепляется к ворсинкам кишечника. Питаются лямблии веществами с поверхности клеток кишечного эпителия. Лямблии обитают в тонкой кишке, иногда проникают в желудок и желчный пузырь.
Биологияразвития (рис. 2.21). Существуют вегетативные формы лямблий и цисты, которые из них образуются. Из одной цисты при заглатывании ее новым хозяином образуется 2 трофозоита. Вегетативная форма имеет длину 10-18 мкм, ширину 8-10 мкм. Дорсальная сторона тела выпуклая, вентральная уплощена, и на передней расширенной стороне имеются присасы-
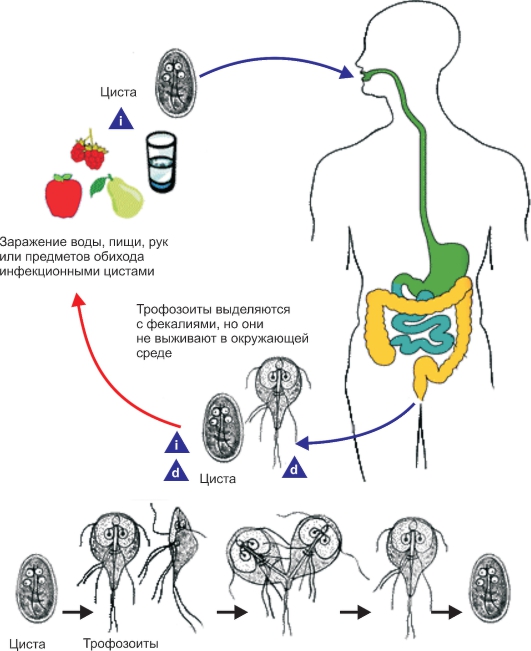
Рис. 2.21.Жизненный цикл Lamblia intestinalis. i - инфекционная стадия; d - диагностическая стадия.
вательные диски. Захватывая с помощью диска микроворсинки щеточной каемки, лямблия удерживается на поверхности слизистой оболочки. Она «откачивает» раствор питательных веществ из промежутков между ворсинками. У человека максимум численности лямблий приходится на верхние 2,5 м тонкой кишки. Здесь же наиболее высока интенсивность контактного пищеварения и всасывается большая часть углеводов, белков, жиров, витами-
нов, минеральных солей и микроэлементов. Лямблии способны поглощать питательные вещества и различные ферменты непосредственно из щеточной каемки, а следовательно, вмешиваться в процесс мембранного пищеварения и нарушать его. В более поздние периоды лямблии перемещаются из проксимальных в средние или дистальные отделы тонкой кишки.
Большинство исследователей отрицают возможность паразитирования лямблий в желчных путях, желчном пузыре. Концентрированная желчь оказывает губительное действие не только на лямблий, но и на другие простейшие.
Образование цист происходит в дистальном отделе тонкой кишки и в ободочной кишке и длится 12-14 ч. Здесь под влиянием неблагоприятных для них условий лямблии инцистируются. Вначале они теряют подвижность, на поверхности их тела появляются псевдоподиеобразные выпячивания цитоплазмы, жгутики отбрасываются. Тело приобретает овальную форму, происходит деление ядер. Цисты, покрытые плотной оболочкой, имеют округлую или овальную форму. На переднем конце видны 4 ядра, тесно прилегающие друг к другу, аксонемы и серповидно изогнутые фибриллы, длина которых 8-12 мкм, ширина 7-10 мкм. Как правило, из кишечника хозяина наружу выходят только цисты. Вегетативные стадии могут попадать во внешнюю среду лишь при очень сильных кишечных расстройствах.
Размножение лямблий происходит путем продольного деления. Сначала делятся ядра, потом присасывательный диск и кинетосомы. У дочерних особей жгутики формируются заново. Цитокинез начинается с расширенного переднего конца тела.
Эпидемиология. Лямблиоз распространен во всем мире. В большинстве стран, в том числе в России, случаи лямблиоза (жиардиаза) подлежат обязательной регистрации и статистическому учету. Во всем мире клинические формы лямблиоза обнаруживают примерно у 500 тыс. больных в год. В Российской Федерации ежегодно регистрируют более 100 тыс. больных, из них до 90 тыс. детей.
Лямблиоз относится к контагиозным протозоозам. Факторами передачи возбудителя являются грязные руки, вода, пища, содержащие цисты лямблий. Насекомые (мухи, тараканы, мучные хрущаки, навозные жуки) также могут способствовать распространению цист лямблий. Механизм передачи инвазии гео-оральный. Заражающая доза составляет 10-100 цист.
Период выделения цист у человека начинается в среднем на 9-12-е сутки после заражения и может длиться многие месяцы. Возможно бессимптомное носительство.
Частота лямблиоза у детей в возрасте до 9 лет в 2-3 раза превышает таковую у взрослых. Дети начинают заражаться с 3-месячного возраста.
Патогенез. Лямблии размножаются в кишечнике человека в огромных количествах, что не может быть безразличным для организма хозяина. В течение жизни они многократно прикрепляются к стенке кишки и открепляются от нее, что вызывает механическое раздражение, а также воздействует на нервные окончания стенки кишки и может привести к патологическим рефлекторным реакциям со стороны органов пищеварения. Происходят усиление митотических процессов и частая смена эпителия с заменой зрелых и функционально полноценных клеток молодыми, функционально незрелыми. Это приводит к нарушению всасывания пищевых веществ, в первую очередь жиров и жирорастворимых витаминов, а также углеводов и белков.
Длительное паразитирование лямблий в организме человека вызывает нарушение функций печени и кишечника.
Клинические проявления. Острый период лямблиоза характеризуется диареей, тошнотой, анорексией, резкими болями в эпигастрии и мезогастрии,
вздутием кишечника. Часты жалобы на головные боли, уменьшение массы тела, повышенную утомляемость.
Диагностика. Диагноз устанавливают путем микроскопического исследования фекалий и дуоденального содержимого. В дуоденальном соке обнаруживают вегетативные формы. В плотных оформленных фекалиях обнаруживают только цисты, а в жидких наряду с цистами можно найти и вегетативные формы.
Профилактика. Основными мерами профилактики лямблиоза являются предотвращение фекального загрязнения внешней среды, продуктов питания, воды, соблюдение правил личной гигиены, уничтожение механических переносчиков (мух и тараканов).
Тип Apicomplexa
Род Toxoplasma. Этот род представлен одним видом - T. gondii.
Токсоплазма(Toxoplasma gondii). T. gondii вызывает токсоплазмоз - широко распространенное заболевание. Заражение человека в основном происходит алиментарным путем при употреблении пищи, зараженной токсоплазмами, или при контакте с инфицированными кошками.
Биология развития (рис. 2.22). Возбудитель токсоплазмоза - облигатный внутриклеточный паразит. Доказана возможность внутриядерного паразитизма токсоплазмы. Она была обнаружена в 1908 г. независимо друг от друга Ш. Николем и А. Мансо в Тунисе у грызунов гонди и А. Сплендоре в Бразилии у кроликов. Родовое обозначение токсоплазмы отражает полулунную форму бесполой стадии паразита (греч. toxon - лук с натянутой тетевой, plasma - форма), видовое - название грызунов гонди.
С общебиологической точки зрения T. gondii характеризуется признаками, позволяющими рассматривать ее как паразита с очень глубокими приспособлениями. Он обнаружен на всех континентах и на всех географических широтах, может паразитировать и размножаться в сотнях видов млекопитающих и птиц, поражать самые разнообразные ткани и клетки хозяев.
В 1965 г. Хатчисон впервые экспериментально доказал, что в передачу T. gondii вовлечены кошки. В 1970 г. ученые Англии, Дании и США почти одновременно и независимо друг от друга обнаружили в фекалиях токсоплазмозных кошек ооцисты, очень похожие на таковые у кокцидий. Тем самым была доказана принадлежность токсоплазмы к кокцидиям, и вскоре был точно определен жизненный цикл паразита, состоящий из двух фаз: кишечной и внекишечной, или тканевой.
Кишечная фаза жизненного цикла токсоплазмы включает развитие в клетках слизистой оболочки кишечника окончательных хозяев, которыми являются домашняя кошка и другие представители кошачьих (дикая кошка, рысь, бенгальский тигр, оцелот, снежный барс, ягуарунди, эйр).
Полный цикл развития T. gondii может проходить только в организме представителей семейства кошачьих. Жизненный цикл токсоплазмы включает 4 основных этапа развития: шизогонию, эндодиогению (внутреннее почкование), гаметогонию, спорогонию. Все они проходят в разной экологической среде: шизогония, гаметогония и начало спорогинии протекают только в кишечнике представителей кошачьих (окончательные хозяева токсоплазмы), спорогония завершается во внешней среде, а эндодиогения проходит в клетках тканей промежуточного хозяина (в том числе человека) и в клетках основных хозяев - кошачьих.
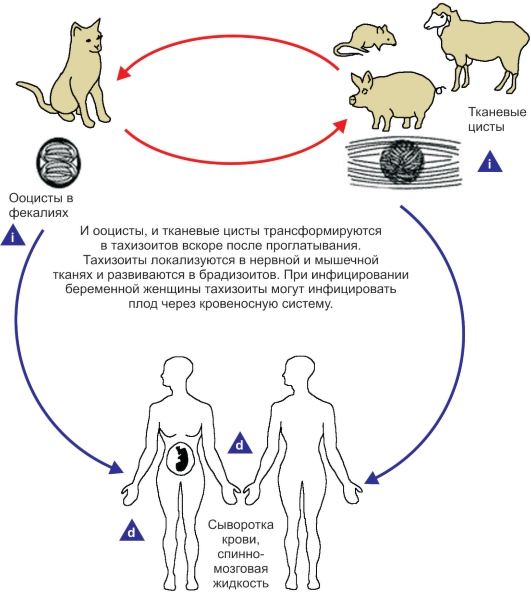
Рис. 2.22.Жизненный цикл Toxoplasma gondii.
i - инвазионная стадия; d - диагностическая стадия: 1) серологический метод диагностики или 2) прямое обнаружение паразита в периферической крови, амниотической жидкости или тканях.
Кишечная фаза развития токсоплазмы в организме окончательного хозяина. Кишечная стадия развития начинается при заражении (пероральном) кошачьих - основных хозяев паразита - как ооцистами со спорозоитами, так и вегетативными стадиями - эндозоитами и цистозоитами, заглатываемыми с тканями промежуточных хозяев. Цистозоиты попадают в кишечник в тканевых цистах, оболочка которых под действием протеолитических ферментов быстро разрушается. Эндозоиты и освободившиеся от оболочки цистозоиты проникают в клетки слизистой оболочки кишечника и путем бесполого размножения - эндодиогении и шизогонии - интенсивно размножаются.
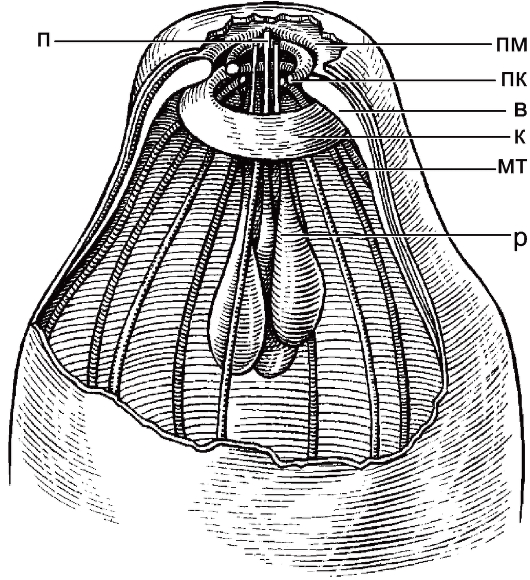
Рис. 2.23.Ультраструктура оокинеты токсоплазмы и малярийного плазмодия.
п - проток роптрий; пм - поверхностная мембрана; пк - полярное кольцо; в - воротник; к - кольцо; мт - микротрубочки; р - роптрии.
Примерно через 2 сут в результате многократно повторяющихся циклов бесполого размножения (шизогонии) образуется особый тип шизонтов (мерозоиты), которые дают начало следующей стадии развития паразита - гаметогонии.
При попадании в кишечник кошки зрелых ооцист токсоплазмы, освободившихся от оболочек, спорозоиты проникают в клетки реснитчатого эпителия кишечника и также начинают размножаться путем шизогонии. В результате бесполого размножения из одного шизонта образуется от 4 до 30 мерозоитов.
Развитие микрогаметоцитов сопровождается рядом последовательных делений яйца. Развитие макрогаметоцита происходит без деления ядра. Оплодотворение, т. е. слияние макро- и микрогамет, происходит в клетке эпителия, в результате чего образуется зигота, которая формирует плотную оболочку и превращается в оокинету (рис. 2.23), а затем в ооцисту. Ооцисты имеют оваль-
ную форму и диаметр от 9-11 до 10-14 мкм. Некоторое время ооцисты остаются в клетках эпителия, но затем выпадают в просвет кишечника, и токсоплазма вступает в следующий этап развития - спорогонию, которая продолжается в фекалиях и во внешней среде.
При достаточных влажности, температуре и доступе кислорода через несколько дней внутри ооцисты формируются две спороцисты с четырьмя банановидными спорозоитами в каждой.
Внекишечная (тканевая) фаза развития токсоплазмы в организме промежуточных хозяев. В клетках различных тканей промежуточных хозяев, в том числе человека, происходит бесполое размножение токсоплазм путем эндодиогении, т. е. образования двух дочерних клеток внутри материнской. В 1969-1970 гг. выявлен способ множественного внутреннего почкования, для которого предложен термин «эндополигения». Бесполое размножение этими двумя способами наряду с шизогонией было обнаружено также в кишечнике основного хозяина паразита - кошки.
Тканевая фаза развития токсоплазмы начинается при попадании в кишечник животных и человека (промежуточных хозяев) либо половых стадий паразита - ооцист со спорозоитами, либо бесполых стадий (эндозоитов и цистозоитов) с тканями инвазированных животных. В тонком отделе кишечника под влиянием протеолитических ферментов высвободившиеся из ооцист спорозоиты либо высвободившиеся из цист цистозоиты или эндозоиты проникают в эпителиальные клетки слизистой оболочки кишечника, где начинается их бесполое размножение - эндодиогения и эндополигения.
В результате размножения развиваются эндозоиты. Через 2-10 ч после внедрения в клетку спорозоита (эндозоита) из разрушенной клетки хозяина выходит 12-24-32 дочерних эндозоита. Вновь образовавшиеся эндозоиты активно внедряются в соседние клетки.
Постепенно вокруг скоплений эндозоитов образуется истинная паразитарная оболочка, и токсоплазма переходит в новую стадию - истинную тканевую цисту. В образование сложной оболочки цисты вовлечены сами паразиты, и это наблюдается при хроническом токсоплазмозе. Такие оболочки непроницаемы для антител и обеспечивают жизнеспособность паразита в течение многих лет, а иногда и пожизненно. Цисты, как правило, находятся внутри клетки, хотя доказана и внеклеточная их локализация. Диаметр цист составляет от 50-70 до 100-200 мкм. С формированием цисты эндозоиты в ней превращаются в новую стадию - цистозоиты. В зрелой цисте может присутствовать несколько тысяч цистозоитов.
Биологическое назначение тканевых цист очень велико. Прежде всего цисты обеспечивают выживание паразита в иммунном организме и тем самым повышают вероятность заражения токсоплазмозом как окончательного, так и новых особей промежуточных хозяев. Образование цистной стадии является важным этапом в жизненном цикле токсоплазмы, так как цистозоиты значительно устойчивее к внешним факторам, чем эндозоиты.
Таким образом, из описания жизненного цикла токсоплазмы следует, что промежуточные хозяева (дикие и сельскохозяйственные животные, а также человек) являются носителями вегетативных (тканевых) стадий паразита, т. е. эндозоитов в цистах. Именно с ними при диагностике токсоплазмоза приходится иметь дело врачам, ветеринарам и паразитологам.
Первично токсоплазма - паразит кошачьих, в организме которых она способна без участия других хозяев завершить как кишечную, так и внекишечную (тканевую) фазы развития. Тем самым кошачьи могут одновременно выполнять функции промежуточных и окончательных хозяев. Между тем токсоплазма - не моноксенный паразит. В его жизненный цикл вовлечены промежуточные хозяева, хотя их участие и необязательно; поэтому для токсоплазмы характерна факультативная гетерогенность, причем эндозоитами и цистозоитами - стадиями из промежуточных хозяев - могут заражаться не только окончательные хозяева, но и новые промежуточные хозяева (плотоядные животные и человек). В данном случае имеет место своего рода пассирование или перевивка без участия окончательного хозяина и без выхода токсоплазмы во внешнюю среду.
У многих животных (мыши, крысы, морские свинки, хомяки, кролики, собаки, овцы, свиньи) и человека отмечена трансплацентарная передача возбудителя в стадии эндозоита, что свидетельствует о существовании врожденного токсоплазмоза.
Эпидемиология. Токсоплазмоз - первично природно-очаговая инвазия, т. е. зооноз диких животных [Засухин Д. Н., 1952; Jirovec, 1952]. В настоящее время, однако, токсоплазмоз с эпидемиологической точки зрения следует расценивать как зооноз сельскохозяйственных и домашних животных. Человек вовлекается в циркуляцию возбудителя, как правило, в населенном пункте, т. е. в синантропном очаге токсоплазмоза. Есть основания считать, что наиболее распространенным фактором передачи возбудителя человеку является мясо инвазированных сельскохозяйственных животных. Гео-оральный механизм передачи инвазии человеку реализуется, по-видимому, гораздо реже, однако это не должно преуменьшать эпидемиологическую значимость кошек.
Клинические проявления. В соответствии с Международной статистической классификацией болезней и проблем, связанных со здоровьем, принятой ВОЗ в 1998 г., выделяют следующие нозологические формы: токсоплазмоз с вовлечением глаз, токсоплазмоз с гепатитом, токсоплазмоз с менин-
гоэнцефалитом, токсоплазмоз с пневмонией, пневмонитом, токсоплазмоз с вовлечением других органов, миокардит при токсоплазмозе и миозит при токсоплазмозе, а также врожденный токсоплазмоз.
Токсоплазмоз с вовлечением глаз протекает по типу катаракты. Он может также сочетаться с поражением ЦНС и сердца. Поражение глаз носит хронический характер с рецидивами, постепенно развиваются очаги пигментной дегенерации, атрофические очаги на сетчатке глаза, атрофия диска зрительного нерва, приводящие к прогрессирующему ухудшению зрения и слепоте.
Токсоплазмоз с гепатитом характеризуется увеличением печени (основной симптом), которая при пальпации может быть болезненной, однако значительных нарушений функции печени, как правило, не наблюдается. Нередко регистрируют и увеличение селезенки.
Токсоплазмоз с менингоэнцефалитом проявляется симптомами общей интоксикации, высокой температурой тела, сильной головной болью, нарушением сознания, судорогами. Важное диагностическое значение имеет исследование ликвора, в котором можно обнаружить токсоплазмы.
Токсоплазмоз с пневмонией, пневмонитом обычно развивается в острой стадии заболевания при генерализации инфекции. Пневмония при этом чаще всего двусторонняя, интерстициальная, характеризуется затяжным течением. После угасания острого процесса в легких остаются мелкие рассеянные кальцификаты.
Миокардит при токсоплазмозе диагностируют, когда доминирующим симптомом заболевания является поражение сердца. Между тем следует подчеркнуть, что клиническая картина существенно не отличается от картины миокардитов другой этиологии.
Миозит при токсоплазмозе характеризуется болями в мышцах. При рентгенологическом обследовании в них обнаруживают кальцификаты.
По характеру течения инфекции выделяют острую, хроническую и латентную формы. При острой форме после продромального периода (до 2 нед), во время которого отмечают слабость, повышенную утомляемость, мышечные боли, наиболее характерным симптомом является увеличение лимфатических узлов (в шейной, затылочной, подчелюстной и подмышечной областях), возможно повышение температуры тела. Могут наблюдаться образование кальцификатов, увеличение печени и селезенки, миокардиты и пневмонии, а также тяжелые поражения ЦНС (энцефалит, менингоэнцефалит). Инкубационный период длится от 3 до 14 дней. Лечение токсоплазмоза в острой форме наиболее эффективно.
Хроническая форма токсоплазмоза чаще всего протекает бессимптомно, но возможны слабость и быстрая утомляемость, иногда головные боли, а также субфебрильная температура.
Для хронического приобретенного токсоплазмоза характерно длительное течение с периодическими обострениями. Заболевание протекает нетяжело, за исключением нейротоксоплазмоза. Лечение хронического токсоплазмоза целесообразно проводить в периоды обострения.
При латентной форме инфекция протекает скрытно, без клинических симптомов.
Врожденный токсоплазмоз. Трансплацентарное заражение плода происходит только при свежем инфицировании матери во время беременности. Врожденный токсоплазмоз может иметь острое течение и затем переходить в хроническую или латентную форму. Острая форма крайне тяжелая (судороги, параличи, тяжелые поражения мозга), характеризуется высокой летальностью, в том числе внутриутробной (самопроизвольный выкидыш, мертворождение).
Хроническая форма врожденного токсоплазмоза характеризуется волнообразной лихорадкой с прогрессирующим поражением ЦНС (гидроцефалия, эпилепсия и др.), глаз (хориоретинит) и других органов (резидуальный врожденный токсоплазмоз). Клиническая картина врожденного токсоплазмоза зависит от сроков беременности на момент заражения и массивности инвазии. Возможно и латентное течение врожденного токсоплазмоза без клинических проявлений.
Токсоплазмоз и беременность. Актуальность проблемы токсоплазмоза обусловливают серьезные последствия первичного заражения женщин в период органогенеза, в ранние сроки беременности (гибель плода, уродства и т. д.). Все женщины, планирующие беременность, и беременные (желательно в ранние сроки) должны быть обследованы на наличие в сыворотке крови антител к токсоплазме.
Лабораторная диагностика заболевания, перенесенного в прошлом, или обнаружение острой инфекции T. gondii у беременной женщины предусматривает применение серологических методов. Сероконверсию обычно оценивают путем определения IgG или к антигенам токсоплазмы в парных сыворотках, взятых с интервалом 2-3 нед.
Токсоплазмоз у детей. Внутриутробный токсоплазмоз является результатом первичной инфекции у матери, протекающей с клиническими симптомами или бессимптомно. Признаки внутриутробного токсоплазмоза у новорожденных при первичном заражении во второй половине беременности, проявляющиеся в первые месяцы жизни, чаще всего неврологические. Появление последствий или рецидив возможны в более поздние сроки развития ребенка (хориоретиниты, ретинопатия недоношенных или субклиническая симптоматика).
Пути заражения. Основной путь - пероральный. Человек заражается ооцистами при употреблении овощей, ягод, сырой воды, при контакте с кошками и почвой, цистами либо тахизоитами - при употреблении непрожаренного мяса и сырого молока.
При контактном пути заражение происходит через слизистые оболочки и поврежденную кожу; такой путь возможен при тесном контакте с больными животными.
Трансплацентарный (конгенитальный) путь предполагает внутриутробное заражение плода через плаценту. Источником инфекции является беременная женщина со свежей инфекцией, когда имеет место паразитемия и токсоплазмы через плаценту, где формируется первичный очаг, гематогенным путем попадают в плод.
Трансплантационный путь заражения реализуется при пересадке органов от донора с токсоплазмозом. Также доказана передача возбудителя при переливании крови или лейкоцитной массы.
Заболеваемость населения токсоплазмозом в различных странах часто зависит от степени употребления полусырых мясных блюд, предусмотренных кулинарной практикой (до 90 % во Франции, 45-80 % в Голландии, 18-20 % в США).
Диагностика включает применение паразитологических и иммунологических методов. Для обнаружения токсоплазм проводят микроскопические исследования, реакцию прямой иммунофлюоресценции и биопробы на белых мышах. Разработаны метод иммуноблоттинга с IgМ, IgG, IgA для выявления белков возбудителя и полимеразная цепная реакция. Для диагностики внутриутробного токсоплазмоза используют методы кордоцентеза и амниоцентеза. Между тем эти методики имеют ограниченное применение в практической медицине, поскольку требуют больших денежных затрат, специальных оборудования и подготовки персонала.
В подавляющем большинстве случаев прибегают к серологическим тестам. Серодиагностика токсоплазмоза основана на обнаружении Ig классов G, М, А, Е.
Профилактика. Теоретически наиболее радикальные пути профилактики токсоплазмоза человека - элиминация и надежная санация окончательных хозяев паразита, т. е. кошек. В этом смысле профилактика токсоплазмоза близка к профилактике бешенства. Нет сомнения в том, что полное уничтожение беспризорных кошек и надежный ветеринарный надзор за домашними кошками - залог если не полного оздоровления синантропных очагов токсоплазмоза, то во всяком случае - снижения пораженности населения в них в десятки и тысячи раз.
Род Plasmodium. Малярийные плазмодии вызывают малярию - острое протозойное заболевание человека с трансмиссивным механизмом заражения, характеризующееся выраженными симптомами интоксикации, циклическим течением с чередованием приступов лихорадки и периодов апирексии, увеличением селезенки и печени, развитием гемолитической анемии при прогредиентном течении, рецидивами.
Историческая справка. Изучение малярии (одной из древнейших болезней человека) неразрывно связано с историей развития человеческой цивилизации. Предполагается, что малярия стала распространяться на Земле (из Африканского региона Средиземноморья) около 10 000 лет назад в связи с интенсивным развитием земледелия, торговли, освоением новых земель. В старинных египетских папирусах, древней китайской литературе и канонах (Charaka и Sushrutha) классической древнеиндийской медицины (Ayurveda) до нашего времени сохранились описания клинической картины и эпидемий малярии, и уже тогда высказывались предположения о возможной связи болезни с укусами комаров. Позже (VI-V вв. до н. э.) врачи Древней Греции Гиппократ и Эмпедокл подробно описали клинику малярии. Гиппократу принадлежит заслуга в том, что он выделил малярию из группы лихорадочных заболеваний и предложил различать 3 формы болезни: «quotidian» (ежедневные приступы), «tertian» (приступы через день) и «quartan» (приступы через 2 дня).
Эпоха научных открытий в изучении малярии началась в 1640 г., когда испанский врач-конкистадор Хуан дель Вего впервые для лечения больных малярией использовал настой коры хинного дерева, ранее использовавшийся индейцами Перу и Эквадора как противолихорадочное средство. Своим названием малярия обязана итальянскому естествоиспытателю Д. Ланчизи (1717), который связывал заражение людей с «ядовитыми» испарениями болот (итал. mal aria - дурной воздух). В 1880 г. французский врач A. Лаверан, работая в Алжире, подробно описал морфологию возбудителя малярии. В 1897 г. английским военным врачом Р. Россом в Индии был установлен трансмиссивный механизм передачи малярии.
В настоящее время малярия является одной из серьезнейших проблем здравоохранения для более 100 стран Африки, Азии и Южной Америки, около половины населения Земли живут в условиях риска заражения малярией. Практически во всех странах Европы и Северной Америки ежегодно регистрируют сотни завозных случаев малярии среди людей, прибывших из регионов ее распространения; растет число случаев так называемой «аэропортной» малярии. По данным ВОЗ, ежегодно в мире малярией заболевают 200-250 млн человек, не менее 80 % всех случаев малярии регистрируют в странах Африки, расположенных к югу от Сахары. Каждый год от малярии умирают от 1 до 2 млн человек, в основном детей в возрасте до 5 лет. Социальные и экономические потери только в Африке оценивают в 2 млрд долл. США в год. С 1998 г. под эгидой ВОЗ, Всемирного банка и
ЮНИСЕФ реализуется научнопрактическая программа (Roll Back Malaria Initiative) по контролю за малярией (в основном в развивающихся странах). Программа рассчитана до 2010-2015 гг. Активно ведутся разработки по созданию эффективной противомалярийной вакцины, однако для этого потребуется как минимум еще 10-15 лет. Поиск, разработка и совершенствование препаратов для лечения малярии являются одними из приоритетных направлений деятельности ВОЗ, различных фармацевтических компаний, научно-исследовательских институтов во всем мире. В последние годы в России в результате роста миграционных процессов, интенсивного развития международного туризма отмечено увеличение числа завозных случаев малярии.
Этиология. Название болезни «малярия» фактически обобщает четыре отдельных протозойных заболевания, вызываемых соответственно четырьмя видами возбудителей. Возбудители малярии относятся к подцарству Protozoa, типу Apicomplexa, роду Plasmodium, который подразделяется на два подрода: Plasmodium и Laverania (табл. 2.3).
Для каждой из четырех форм малярии характерны свои клинические, патогенетические и эпидемиологические особенности. Важнейшее место занимает малярия falciparum, возбудитель которой относится к особому подроду (Laverania). Только малярия falciparum может протекать злокачественно, приводя к летальному исходу, на ее долю приходится 80-90 % от всех случаев малярии в мире.
Эпидемиология. При малярии возможны различные механизмы передачи инфекции.
♦ Трансмиссивный механизм (при укусе комара). Этот механизм является основным, обеспечивающим существование плазмодиев как биологического вида. Источник инфекции - человек (больной малярией или паразитоноситель), в крови которого имеются зрелые гаметоциты (мужские и женские половые клетки паразита) (рис. 2.24). Переносчики малярии - только женские особи комаров рода Anopheles.
В желудке комара, куда вместе с кровью попадают мужские и женские гаметоциты, находящиеся внутри эритроцитов, происходит их дальнейшее созревание (после лизиса эритроцитов), слияние и многократное деление с образованием спорозоитов, которые накапливаются в слюнных железах комара. Бесполые формы паразита (трофозоиты, шизонты), попав в желудок комара, погибают.
Таким образом, в организме человека происходит бесполое развитие паразитов (шизогония) с образованием и накоплением гаметоцитов, в организме комара - половое развитие (спорогония), слияние мужских и женских гамет с дальнейшим развитием и образованием спорозоитов.
♦ Вертикальный механизм передачи (от матери плоду или от матери новорожденному, в процессе родов - парентеральный механизм). При вертикальной передаче плод редко заражается через плаценту. Чаще заражение происходит во время родов при попадании в кровоток новорожденного не-
Таблица 2.3. Возбудители и формы малярии
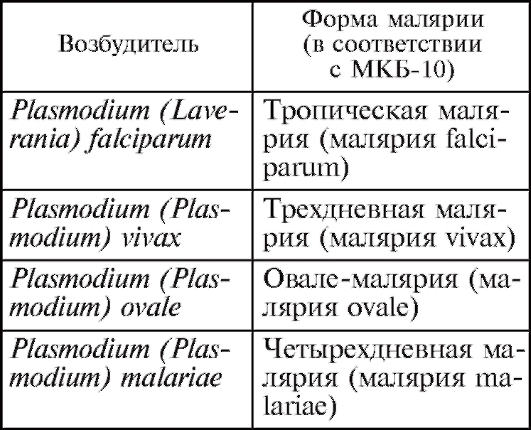
Рис. 2.24.Эритроциты, пораженные малярийным плазмодием.
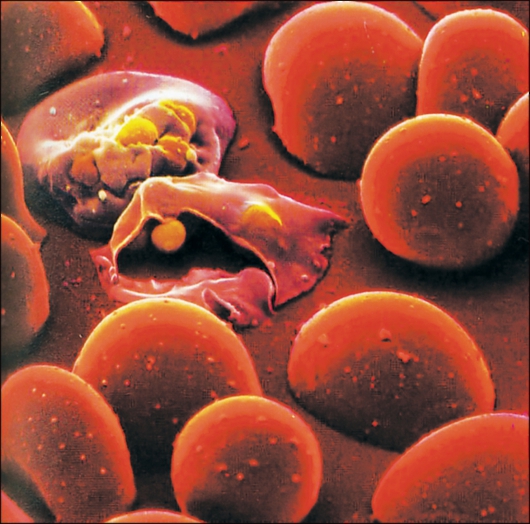
которого количества материнской крови, в эритроцитах которой находятся бесполые формы паразита.
♦ Парентеральный механизм заражения приводит к развитию так называемой шизонтной малярии. Он наблюдается при гемотрансфузиях и реже при нарушениях асептики при инъекциях (например, среди наркоманов, использующих один шприц). В случае заражения при переливании крови источником инфекции является донор-паразитоноситель, часто имеющий субпатентную паразитемию (количество паразитов менее 5 в 1 мкл крови). В связи с этим в эндемичных по малярии регионах мира для контроля донорской крови необходимо использовать наряду с паразитологическими методами (определение паразита в препаратах толстой капли и мазках крови) и серологические (иммунологические) методы лабораторной диагностики малярии - реакцию непрямой иммунофлюоресценции (РНИФ), иммуноферментный анализ (ИФА) и др. Поскольку при парентеральном заражении обычно вводится небольшое количество паразитов (особенно при инъекциях), инкубационный период может длиться до 3 мес (при массивном заражении инкубационный период, наоборот, может быть и очень коротким - несколько дней), что важно знать при диагностике малярии у больных, перенесших хирургическую операцию, наркоманов.
Для распространения малярии в определенном регионе (стране, крае, области) необходимы следующие условия.
♦ Источник инфекции (больной малярией или паразитоноситель).
♦ Наличие эффективного переносчика (комары рода Anopheles).Восприимчивость к малярийным паразитам - главное качество конкретного вида комаров из этого рода. Численность комаров родаAnopheles среди популяций других видов не столь высока, как немалярийных комаров, и они в редких случаях серьезно беспокоят своими укусами. Между тем и малочисленные виды при прочих благоприятных условиях (близость мест вы-
плода комаров к жилищу людей) могут играть достаточно существенную роль. Более 70 видов комаров рода Anopheles (среди более 200 известных видов) могут служить эффективными переносчиками малярии.
♦ Благоприятные климатические условия (среднесуточная температура воздуха выше 16 оС и наличие мест для выплода комаров: водоемы, резервуары для воды, ирригационные сооружения и др.). Минимальная среднесуточная температура воздуха, необходимая для развития в организме комара P. vivax, - 16 оС, P. falciparum - 18 оС, при более низкой температуре спорогонии не происходит. Продолжительность спорогонии тем меньше, чем выше температура, но до определенного уровня, так как среднесуточная температура 30 оС и выше неблагоприятна для спорогонии. При оптимальной среднесуточной температуре (25-26 оС) спорогония P. vivax длится 8-9 дней, P. falciparum - 10-11 дней.
Весь ареал распространения малярии на земном шаре (от 45о с. ш. и 40ою. ш. до 64о с. ш. и 45о ю. ш. в разные годы) занимает малярия vivax. Ареал малярии falciparum и малярии malariae несколько меньше вследствие необходимости в более высокой температуре для эффективной спорогонии, ареал малярии ovale расположен в двух не связанных территориально регионах - тропической Африке и государствах западной части Тихого океана (Индонезия, Вьетнам, Филиппины, Новая Гвинея и др.). В горных странах очаги малярии могут формироваться до высоты 1000 м в зоне умеренного климата и до 1500-2500 м в зоне субтропиков и тропиков, причем на больших высотах (1000-1500 м и выше) встречаются очаги только малярии vivax.
Малярия отличается выраженной сезонностью. В условиях умеренного и субтропического климата малярийный сезон делится на периоды эффективной заражаемости комаров, передачи инфекции и массовых проявлений заболевания. Начало периода эффективной заражаемости комаров (при наличии источников инфекции - больных, паразитоносителей) совпадает с моментом устойчивого повышения среднесуточной температуры до 16 оС. Начало периода передачи инфекции связано с завершением спорогонии в организме комара, что зависит от конкретных среднесуточных температур данного года. В Московском регионе длительность периода передачи малярии vivax может достигать 1,5-2 мес и более, до первых осенних заморозков. Границы периода массовых проявлений менее определенны. В очагах, где передается только трехдневная малярия, период массовой заболеваемости может начинаться задолго до начала периода передачи. Наблюдаемые случаи представляют собой первичные проявления малярии vivax с длительной инкубацией (3- 10 мес) за счет заражения в прошлом сезоне и сохранения в печени гипнозоитов (без первичных проявлений с короткой инкубацией), а также отдаленные экзоэритроцитарные рецидивы (после серии приступов малярии с короткой инкубацией в прошлом сезоне без адекватной противорецидивной терапии).
Восприимчивость к малярии всеобщая. Исход заражения после попадания возбудителя в кровоток и клиническое течение болезни зависят от индивидуального иммунологического статуса, активности действия факторов неспецифической врожденной резистентности, напряженности постинфекционного иммунитета, а у новорожденных - от уровня специфических антител класса G, полученных от матери. Исключение составляют коренные жители Западной Африки и Новой Гвинеи, в большинстве своем невосприимчивые к заражению P. vivax, что связано с генетически детерминированным отсутствием у них эритроцитарных изоангигенов системы Даффи, выполняющих функцию рецепторов для мерозоитов P. vivax. Соответственно в этом регионе значительно реже, чем в других регионах тропической Африки, регистрируют случаи малярии vivax.
Относительной устойчивостью к заражению всеми видами плазмодиев обладают лица, являющиеся носителями аномального гемоглобина (при талассемии, серповидно-клеточной анемии, носительстве гемоглобинов Е и С и др.), имеющие нарушения строения цитоскелета эритроцитов (при наследств
Дата добавления: 2016-12-27; просмотров: 3633;











