Отряд Kinetoplastida
К данной группе относятся трипаносомы и лейшмании. Эти паразиты передаются кровососущими паразитами-переносчиками, которые одновременно являются промежуточными хозяевами.
В организме позвоночных животных паразиты присутствуют в крови и тканевых жидкостях, а также внутри клеток. Размножение всегда происходит путем бинарного деления. Единственный жгутик отходит от кинетосомы, расположенной рядом с более крупным дисковидным или изогнутым образованием - кинетопластом, однако при исследовании в световом микроскопе эти два образования дифференцировать невозможно. Кинетопласт, который связан с крупной митохондрией, проходящей через большую часть клетки организма, содержит ДНК, которая генетически отличается от ядерной ДНК. В переносчике жгутик может функционировать как орган прикрепления. Эти паразиты меняют форму тела в процессе смены фаз жизненного цикла (рис. 2.7).
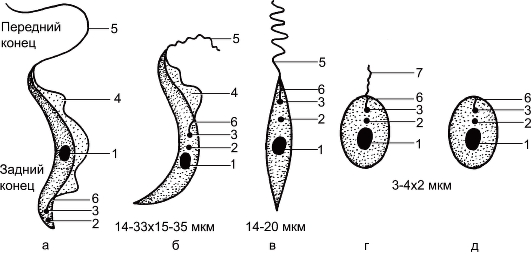
Рис. 2.7.Морфологические формы лейшманий и трипаносом.
а - трипомастигота; б - эпимастигота; в - промастигота; г - сферомастигота (микромастигота); д - амастигота: 1 - ядро; 2 - кинетопласт; 3 - кинетосома; 4 - ундулирующая мембрана; 5 - жгутик; 6 - ризопласт; 7 - рудиментарный жгутик.
Амастигота, или амастиготная (безжгутиковая) стадия, соответствующая прежней лейшманиальной стадии, имеет округлую или удлиненную форму; лишена наружного жгутика у Leishmania, Trypanosoma cruzi.
Сферомастигота (микромастигота), или сферомастиготная стадия,имеет округлую форму с рудиментарным свободным жгутиком (у лейшманий).
Промастигота, или промастиготная (переднежгутиковая) стадия,соответствующая прежней лептомонадной стадии, имеет удлиненную форму; кинетопласт лежит впереди ядра, жгутик начинается там же и выходит наружу в переднем конце тела (у Leishmania, Trypanosoma cruzi).
Эпимастигота, или эпимастиготная (бокожгутиковая) стадия,соответствующая бывшей критидиалъной стадии, характеризуется удлиненной формой; кинетопласт лежит рядом с ядром, жгутик начинается там же и выходит наружу сбоку, после чего проходит по поверхности тела или вдоль короткой ундулирующей мембраны (у трипаносом).
Трипомастигота, или трипомастиготная стадия, соответствующаятрипаносомной стадии, отличается удлиненной формой; кинетопласт лежит позади ядра, жгутик начинается там же и выходит наружу сбоку, после чего проходит по поверхности тела или вдоль длинной ундулирующей мембраны.
Хотя эта форма сходна с эпимастиготной, ее как важную стадию, свойственную роду Trypanosoma, желательно обозначить специальным термином, который определяет ее структуру, но не связан с родовым названием.
Наряду с полиморфизмом трипаносоматид (трипаносомы илейшмании) в процессе их жизненных циклов выявлен также полиморфизм на уровне их геномов. Кариотипы трипаносоматид очень изменчивы. Они сильно различаются даже между разными изолятами одного вида.
Кариотип трипаносом не поддается анализу в световом микроскопе, но при применении электрофореза в геле хромосомы могут быть разделены на 4 основных класса: большая ДНК, остающаяся вблизи щели геля; около 5 длинных хромосом; 5-7 хромосом промежуточного размера и от 0 до 100 сателлитных и теломерных мини-хромосом. Вероятно, эволюция кариотипа происходила в направлении увеличения разнообразия антигенной вариации. Одна особь трипаносомы несет до 1000 поверхностных вариантов генов. Такой полиморфизм является одним из важнейших способов уклонения паразитов от защитных механизмов своих хозяев благодаря изменчивости их поверхностных антигенов.
Так, в каждой новой генерации часть трипаносом несет поверхностный антиген, отличающийся от предыдущих. Эта смена антигенов происходит в результате транспозиции и дупликации генов, кодирующих антигенные детерминанты. В результате меняется расположение гена по отношению к промотору.
Изменение поверхностных генов паразита в сторону сближения с антигенами хозяина обеспечивает так называемую молекулярную мимикрию, или связывание антигенов хозяина.
Локализация паразитов в клетках иммунной системы направленно инактивирует лизосомные ферменты макрофага, что обеспечивает их жизнедеятельность и условия для размножения.
Род Trypanosoma (трипаносомы). Размеры трипаносом больше, чем лейшманий. Трипаносомы имеют узкую продолговатую форму (ширина 1,5-3 мкм, длина 15-30 мкм), жгутик и ундулирующую мембрану. В процессе жизненного цикла изменяются морфологически.
Трипаносомозы - группа трансмиссивных тропических болезней, вызываемых простейшими рода Trypanosoma. Для человека патогенны Т. gambiense и Т. rhodesiense, которые вызывают африканский трипаносомоз (сонная болезнь), и Т. cruzi - возбудитель американского трипаносомоза (болезнь Шагаса).
Трипаносомы проходят сложный цикл развития со сменой хозяев, в процессе которого они находятся в морфологически разных стадиях.
Трипаносомы размножаются продольным делением, питаются растворенными веществами.
Жизненный цикл трипаносом осуществляется со сменой двух хозяев, одним из которых являются позвоночные животные и человек, другим - кровососущие членистоногие, служащие переносчиками возбудителя.
Различают африканский и американский трипаносомозы.
Трипаносома гамбийская (Trypanosoma gambiense). T. gambienseвызывает африканский трипаносомоз (сонная болезнь) - облигатно-трансмиссивную инвазию, характеризующуюся лихорадкой, высыпаниями на коже, увеличением лимфатических узлов, появлением местных отеков и поражением центральной нервной системы, приводящим к летаргии, кахексии и летальному исходу.
Африканский трипаносомоз распространен в зоне саванн. Его нозоареал ограничен ареалом переносчика - мухи цеце. Эта болезнь эндемична в 36 странах тропической Африки. Ежегодно регистрируют до 40 тыс. новых случаев.
Известны два типа африканского трипаносомоза - гамбийский, или западноафриканский, и родезийский, или восточноафриканский. Первый вызывает T. gambiense, второй - T. rhodesiense.
Оба возбудителя африканского трипаносомоза относятся к секцииSalivaria, т. е. передаются через слюну. Гамбийский тип африканского трипаносомоза - это облигатно-трансмиссивное заболевание, фактически антропоноз, хотя в передаче его возбудителя некоторое участие принимают и сельскохозяйственные животные.
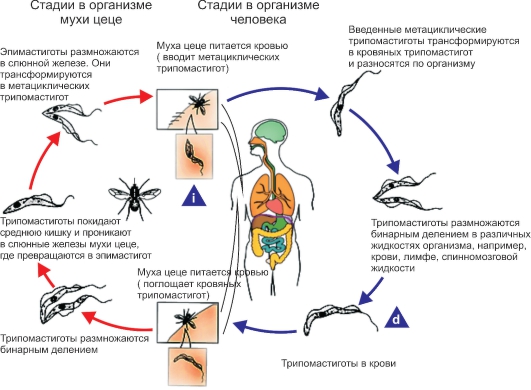
Рис. 2.8. Жизненный цикл Trypanosoma gambiense и Trypanosoma rhodesiense. i - инфекционная стадия; d - диагностическая стадия.
Впервые клинику африканского трипаносомоза описал в 1734 г. английский врач Atkins, наблюдавший эту болезнь у жителей побережья Гвинейского залива (Западная Африка). В 1902 г. P. Ford и J. Dutton нашли в крови человека Т. gambiense. D. Bruce и D. Nabarro установили, что муха Glossina palpalis (цеце) является переносчиком возбудителя болезни.
Этиология. Возбудитель - Trypanosoma gambiense. В крови позвоночных хозяев развиваются полиморфные стадии трипаносом - трипомастиготы и эпимастиготы. (рис. 2.8). Среди них обнаруживаются тонкие трипомастиготные формы длиной 14-39 мкм (в среднем 27 мкм) с хорошо выраженной ундулирующей мембраной и длинной свободной частью жгутика. Их задний конец заострен, кинетопласт находится на расстоянии около 4 мкм от заднего конца тела.
Биология развития. Основным хозяином является человек, дополнительным - свиньи. Переносчиками служат кровососущие мухи рода Glossina, преимущественно G. palpalis. Отличительным признаком мухи цеце является сильно хитинизированный выступающий хоботок, способный прокалывать кожу даже таких животных, как носорог и слон, поэтому любая одежда человека не защитит от мухи цеце. Вторая особенность мухи - великолепная растяжимость стенок кишки, что позволяет ей поглощать количество крови, превышающее массу голодной мухи в десятки раз. Эти особенности обеспечивают надежность передачи возбудителя от донора реципиенту.
Мухи цеце нападают в светлое время суток преимущественно в открытой природе, некоторые антропофильные виды могут залетать в поселки. Кровь пьют и самцы, и самки. Инвазионной стадией для переносчика является трипомастиготная форма. Грипаносомы попадают в организм переносчика при питании кровью инвазированного позвоночного животного или человека. Около 90 % трипаносом, поглощенных мухой цеце, погибают. Остальные размножаются в просвете ее средней и задней кишок.
В первые дни после заражения разнообразные формы трипаносом находятся внутри комка поглощенной крови, окруженного перитрофической мембраной. Они мало отличаются от тех, которые присутствуют в крови человека, но несколько более короткие и имеют слабовыраженную ундулирующую мембрану. Затем трипаносомы выходят в просвет кишечника насекомого.
При попадании в желудок мухи цеце после кровососания трипаносомы к 3-4-му дню изменяются и трансформируются в эпимастиготные формы, становятся более узкими и вытянутыми и интенсивно делятся. Проникнуть в слюнные железы трипаносомы могут и через гемоцель. В слюнных железах трипаносомы претерпевают ряд морфологических изменений, многократно делятся и превращаются в инвазионную для человека и позвоночных стадию - трипомастиготу. Развитие трипаносом в переносчике продолжается в среднем 15-35 дней в зависимости от температуры среды. Эффективное заражение мух происходит при температуре от 24 до 37оС. После заражения муха цеце способна передавать трипаносомы на протяжении всей жизни.
Эпидемиология. Гамбийский тип трипаносомоза является преимущественно антропонозом. Основным источником инвазии служит человек, дополнительным - свинья.
Переносчиками служат кровососущие мухи рода Glossina,преимущественно G. palpalis. Эти виды тенелюбивы, активны в светлое время суток. Они обитают в зарослях растительности по берегам рек и ручьев в ряде районов Западной и Центральной Африки. Мухи цеце живородящие. Самка откладывает единственную личинку прямо на поверхность почвы, в расщелины, под корни деревьев. Личинка сразу зарывается в почву и через 5 ч превращается в куколку. Вылет имаго происходит через 3-4 нед после окукливания.
Достаточно одного укуса зараженной мухи, чтобы человек заболел сонной болезнью, поскольку минимальная инвазирующая доза трипаносом составляет 300-400 паразитов, а муха со слюной за один укус выделяет их около 400 тыс. Больной становится источником инвазии примерно с 10-го дня после заражения и остается им на протяжении всего периода болезни, даже в период ремиссии и отсутствия клинических проявлений.
Теоретически возможен механический занос трипаносом в кровь человека кровососущими членистоногими при повторных кровососаниях после питания на больном человеке, так как на хоботке мух, слепней, комаров, клопов и других членистоногих возбудители сохраняют жизнеспособность в течение нескольких часов. Заражение может происходить также при гемотрансфузиях или при недостаточной стерилизации шприцев во время инъекций. Гамбийский тип трипаносомоза встречается в виде очагов в Западной и Центральной Африке между 15о с. ш. и 18о ю. ш.
Летальность от трипаносомоза в Конго в середине прошлого века составляла около 24 %, а в Габоне - 27,7 %, поэтому трипаносомоз для стран тропической Африки представляет серьезную экономическую и социальную проблему.
Заболеваемость носит сезонный характер. Пик приходится на сухой сезон года, когда мухи цеце концентрируются около оставшихся непересохшими водоемов, интенсивно используемых населением для хозяйственных нужд.
Патогенез и клинические проявления. В течении болезни выделяют 2 стадии: гемолимфатическую и менингоэнцефалитическую, или терминальную (сонную болезнь в узком смысле слова).
Гемолимфатическая стадия наступает через 1-3 нед после инвазирования и связана с распространением трипаносом по организму (по лимфатической и кровеносной системе) из места их первичного внедрения.
Заболевание характеризуется длительным течением. В течение 2-3 нед первичное местное поражение спонтанно исчезает, на его месте остается пигментированный рубец. Грипаносомный шанкр возникает главным образом у некоренных жителей Африки.
Одновременно с появлением первичного аффекта на коже туловища и конечностей могут возникнуть так называемые трипаниды, имеющие вид розовых или фиолетовых пятен различной формы диаметром 5-7 см. У африканцев на фоне темной кожи трипаниды заметны слабее, чем у европейцев. На лице, кистях, стопах и в месте эритематозных высыпаний заметны отеки, отмечается болезненность кожи при ее сжатии.
В период развития шанкра или через несколько дней после его исчезновения паразиты появляются в крови и наблюдается лихорадка неправильного типа с подъемом температуры до 38,5оС (редко до 41оС).
К симптомам гемолимфатической стадии болезни относятся также слабость, потеря массы тела, тахикардия, боли в суставах, гепатоспленомегалия. Нарастают слабость и апатия, являющиеся ранними симптомами поражения ЦНС.
Менингоэнцефалитическая стадия. Спустя несколько месяцев или лет у подавляющего большинства пациентов болезнь переходит во вторую стадию, которая характеризуется поражением ЦНС. Грипаносомы преодолевают гематоэнцефалический барьер и проникают в ЦНС.
Наиболее характерным признаком второй стадии болезни является нарастающая сонливость, которая появляется преимущественно в дневное время, тогда как ночной сон часто бывает прерывистым и беспокойным. Сонливость настолько сильна, что больной может заснуть даже во время приема пищи. Постепенно нарастают и прогрессируют нейропсихические нарушения. При ходьбе больной волочит ноги, выражение его лица угрюмое, нижняя губа отвисает, изо рта течет слюна. Позднее появляются судороги, сменяющиеся параличами.
Диагностика. Предварительный диагноз сонной болезни можно поставить и на основании клинических симптомов, однако неопровержимым подтверждением диагноза сонной болезни служит обнаружение Т. gambiense при лабораторных паразитологических исследованиях.
Для выявления трипаносом проводят исследование пунктатов шанкра, увеличенных лимфатических узлов (до развития в них фиброзных изменений), крови, спинномозговой жидкости. Из полученного субстрата готовят нативные препараты и препараты, окрашенные по Романовскому-Гимзе.
Профилактика и меры борьбы. Комплекс мероприятий по оздоровлению очагов сонной болезни включает выявление и лечение больных, общественную и индивидуальную профилактику населения, борьбу с переносчиками, серологические обследования, прежде всего людей, относящихся к группе риска (охотники, лесорубы, строители дорог и др.). Обследования следует проводить не реже 2 раз в год (перед и после сезона наибольшей опасности заражения).
Иммунитет. Заболевание сонной болезнью не приводит к выработке стойкого иммунитета. Гечение болезни характеризуется периодическими обострениями, что обусловлено изменением морфологии, антигенных осо-
бенностей и численности трипаносом в крови. Численность паразитов в крови хозяина претерпевает периодические колебания от чрезвычайно высокой до очень низкой. Во время высокой паразитемии в крови преобладают тонкие и длинные, а при низком ее уровне - короткие и толстые формы трипомастигот. Колебания численности паразитов в крови хозяина обусловлены защитными реакциями их организма и своеобразным свойством изменять свою антигенную структуру под влиянием этих реакций.
Антигенная изменчивость при сонной болезни, особенно гамбийского типа, - механизм уклонения от воздействия защитных систем хозяина. Антигенная вариабельность обеспечивает возможность хронически рецидивирующего процесса при трипаносомозах. Увеличение численности паразитов в крови стимулирует развитие специфических антител (IgM-ответ хозяина), которые приводят к уничтожению большинства паразитирующей популяции. Те паразиты, которые сохранились (менее чем 1 %), претерпевают антигенную трансформацию, что делает их неуязвимыми для циркулирующих антител, однако по мере увеличения численности нового антигенного варианта возрастает концентрация соответствующих новых специфических антител. Каждый такой повторяющийся цикл занимает несколько дней, заканчиваясь появлением новых антигенных вариантов, резистентных к предшествовавшим вариантам антител. С каждым изменением поверхностных антигенов иммунный механизм позвоночного хозяина активируется, постепенно снижая способность иммунной системы к ответу.
Число антигенов, продуцируемых трипаносомой, неизвестно, но было показано, что одна клетка способна продуцировать до 22 различных специфических для трипаносом антигенов. Материальным субстратом указанных вариаций служат поверхностные антигены гликопротеина (VSG), расположенные на оболочке паразита.
По оценке, многочисленные варианты транскрибируются более чем в 1000 генов, что теоретически возможно для T.b. gambiense. Из этих вариантов только один является генетически доминантным в определенные моменты времени. Экспрессия каждого гена сопровождается перестройкой генов.
Антигенная вариабельность этих паразитов делает получение эффективных вакцин, обеспечивающих длительную защиту, достаточно бесперспективным для контроля данного заболевания.
Трипаносома родезийская (Trypanosoma rhodesiense). T. rhodesienseвызывает африканский трипаносомоз родезийского типа, который во многом сходен с гамбийским типом африканского трипаносомоза, но этозооноз.
Этиология и биология развития. Возбудитель - Т. rhodesiense - по морфологии близок к Т. gambiense. Основными хозяевами Т. rhodesienseслужат различные виды антилоп, а также крупный рогатый скот, козы, овцы и реже человек.
Главными переносчиками возбудителя родезийского типа являются мухи цеце группы morsitans (G. morsitans, G. pallidipes и др.). Они обитают в саваннах и саванновых лесах, более светолюбивы и менее влаголюбивы, чем palpalis, более зоофильны и охотнее нападают на крупных копытных и мелких бородавочников, чем на людей.
Эпидемиология. Резервуарами Trypanosoma rhodesiense в природе являются различные виды антилоп и других копытных. В ряде случаев дополнительным резервуаром может стать крупный рогатый скот.
Зоонозная форма сонной болезни распространена в равнинной саванне в отличие от антропонозной, тяготеющей к долинам рек. В естественных условиях саванны Т. rhodesiense циркулирует по цепи антилопа - муха це-
це - антилопа без участия человека. Человек заражается эпизодически при посещении энзоотичных очагов. Относительную редкость заражения людей в дикой природе можно также объяснить выраженной зоофилией переносчика, вследствие чего мухи цеце соответствующих видов неохотно нападают на человека. В этих условиях заболевают представители определенных профессий - охотники, рыболовы, военнослужащие, а также путешественники. Мужчины болеют значительно чаще, чем женщины и дети.
Патогенез и клинические проявления сонной болезни родезийского типа отличаются более острым и тяжелым течением. Инкубационный период короче, чем при гамбийском типе, и составляет 1-2 нед.
В месте укуса возникает первичный аффект - трипаносомный шанкр - в виде фурункула, который исчезает через несколько дней, оставляя иногда небольшой рубец. Трипаносомный шанкр отмечается не у всех больных, чаще у европейцев, чем у африканцев. В период развития шанкра или через несколько дней после его появления паразит появляется в крови, и с этим ассоциируется начало лихорадочного периода. Лихорадка носит неправильный характер, сопровождается головной болью. Смерть больных при отсутствии лечения нередко наступает через 9-12 мес. Гемолимфатическая фаза инвазии выражена слабо. У всех больных обнаруживают трипаносомы в крови, у многих в СМЖ.
Диагностика такая же, как при гамбийском типе.
Профилактика и меры борьбы такие же, как при гамбийском типе.
Трипаносома американская(Trypanosoma cruzi). T. cruzi вызываетамериканский трипаносомоз (болезнь Шагаса) - трансмиссивную природно-очаговую протозойную болезнь, которая характеризуется наличием острой и хронической фаз. В 1907 г. бразильский врач С. Шагас обнаружил в триатомовых (поцелуйных) клопах, а в 1909 г. выделил из крови больного возбудителя и описал болезнь, названную в честь него болезнью Шагаса.
Этиология. Возбудитель Trypanosoma cruzi отличается от возбудителей африканского трипаносомоза меньшей длиной тела (13-20 мкм) и более крупным кинетопластом трипомастиготных форм. В фиксированных препаратах крови Т. cruzi часто имеет изогнутую форму наподобие букв С или S (С- и S-формы).
Возбудитель американского трипаносомоза относится к секции Stercoralia(лат. stercus- кал, oralis - ротовой), т.е. передается через фекалии клопа-переносчика. Кроме того, для T. cruzi характерна персистенция (лат.persistere - оставаться, упорствовать) - способность паразита сохраняться в организме хозяина в течение всей жизни с развитием резистентности (устойчивости) к реинвазии (повторному заражению). Трипаносомы при этом продолжают медленно размножаться в течение всей жизни хозяина в клетках некоторых тканей.
Биология развития. Цикл развития T. cruzi проходит со сменой хозяев: а) позвоночных животных (более 100 видов) и человека; б) переносчика возбудителя (клопы подсемейства Triatominae) (рис. 2.11).
Цикл развития в переносчике (рис. 2.12). Инвазионной стадией для переносчика, как и для позвоночного животного и человека, являются трипомастиготы. Поскольку колющий ротовой аппарат в отличие от такового мухи цеце у клопов очень слабый и не может проколоть даже кожу человека, они ищут ссадины или слизистые оболочки конъюнктивы, носовой полости, рта (за что получили название поцелуйных клопов).
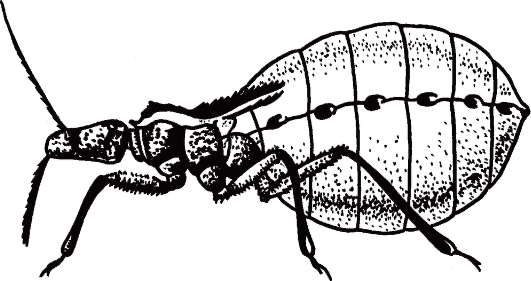
Рис. 2.11.Triatoma infestans (поцелуйный клоп) - специфический переносчик трипаносом, напитавшийся кровью.
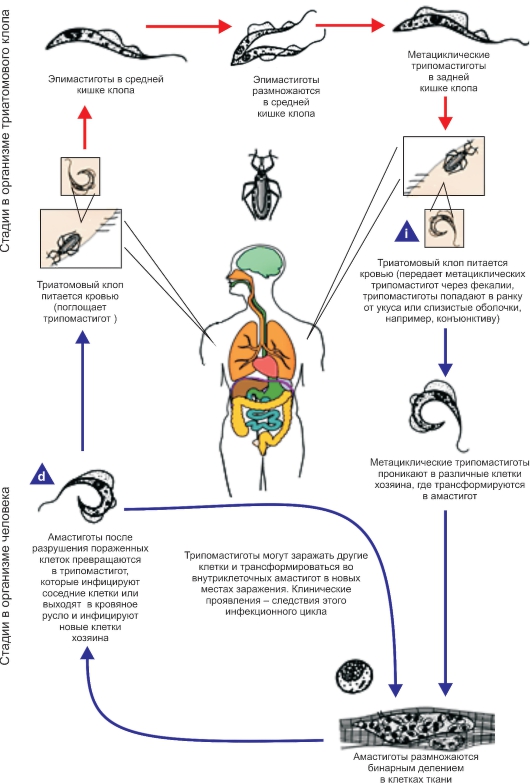
Рис. 2.12.Жизненный цикл Trypanosoma cruzi.
Заражение клопов происходит при питании кровью человека или животных, содержащей трипомастиготы.
Попадая в организм триатомовых клопов (переносчики американского трипаносомоза), T. cruzi достигают желудка насекомого, превращаются здесь в эпимастиготы и размножаются в течение нескольких дней. Затем они проходят в заднюю и прямую кишку, где возвращаются к трипомастиготной форме. С этого момента клопы становятся заразными. После или во время засасывания крови клопы опорожняют прямую кишку, и возбудители попадают на кожу человека или слизистые оболочки. Однократно инвазированный клоп сохраняет паразитов до конца жизни (около 2 лет). Трансовариальная передача отсутствует.
Инвазионной стадией для позвоночного хозяина является трипомастиготная форма. Передача инвазии человеку и другим теплокровным происходит не прямо через укус клопа, а путем контаминации экскрементами клопов, содержащими трипаносом, ранки от укуса или слизистых оболочек. В месте укуса формируется шагома - первичный симптом трипонасомоза.
Как правило, дефекация у клопов происходит непосредственно во время кровососания. Укусы клопов вызывают сильный зуд и воспаление, в результате чего паразиты могут быть занесены в ранку при расчесывании. У человека зарегистрированы также случаи врожденного трипаносомоза.
После попадания в организм позвоночного животного (природного резервуара) или человека трипомастиготы некоторое время остаются в периферической крови, но не размножаются.
Затем они проникают в мышечные клетки и клетки эндотелия легких, печени, лимфатических узлов и других органов, однако паразиты скапливаются преимущественно в клетках сердечной мышцы. Внутри клеток трипомастиготы трансформируются в эпимастиготную, промастиготную формы и в конце трансформации превращаются в округлую безжгутиковую форму - амастиготу длиной 2,5-6,5 мкм, содержащую круглое ядро и мелкий овальной формы кинетопласт. Внутри клетки амастиготы размножаются бинарным делением.
Наполненная амастиготами клетка человека или животного увеличивается в размерах и превращается в псевдоцисту, оболочкой которой служит стенка клетки хозяина. Перед разрывом и сразу после разрыва такой псевдоцисты амастигота (минуя промастиготную и эпимастиготную стадии) превращается в трипомастиготу. Трипомастиготы инвазируют соседние клетки, размножаются в стадии амастигот с образованием новых псевдоцист. Таким образом, амастиготы - сугубо внутриклеточная форма паразита. Часть трипомастигот, высвободившихся из псевдоцисты и не попавших в соседние клетки, попадает в кровь, где циркулирует и может попасть оттуда в организм переносчика.
Эпидемиология. Основными переносчиками возбудителя американского трипоносомоза являются летающие клопы Triatoma megistis, Triatoma infestans и др. Эти насекомые отличаются яркой окраской и сравнительно крупными размерами - 15-35 мм в длину. Нападают на человека и животных ночью. Трансовариальная передача трипаносом из поколения в поколение у триатомовых клопов отсутствует.

Рис. 2.13.Основной резервуар возбудителя в природе - броненосцы Южной и Центральной Америки, имеющие высокий уровень паразитемии.
Передача возбудителя болезни Шагаса происходит по типу специфической контаминации. Грипаносомы, выделенные с фекалиями клопов во время кровососания, проникают в организм человека или животных через поврежденную кожу или слизистые оболочки глаз, носа, полости рта вблизи места укуса. Заражение трипаносомозом возможно также алиментарным путем (в том числе с молоком матери), при гемотрансфузиях.
В настоящее время установлено, что возможна и трансплацентарная передача Т. cruzi, но уровень ее сравнительно невысок: в среднем у больных матерей рождаются 2-4 % инфицированных детей. Механизм протективного действия плаценты полностью не изучен.
Известны синантропные и природные очаги болезни Шагаса. В синантропных очагах, кроме человека, резервуарами возбудителя являются собаки, кошки, свиньи и другие домашние животные. По имеющимся данным, инфицированность собак в синантропных очагах в отдельных районах Бразилии составляет 28,2 %, в Чили - 9 %, кошек в Бразилии - 19,7 %, в Чили - 12 %.
В природных очагах резервуарами возбудителя служат броненосцы (сами не болеют) (рис. 2.13), опоссумы (наиболее важны, так как имеют высокий индекс паразитемии), муравьеды, лисы, обезьяны и др. В Боливии и некоторых районах Перу определенное значение в качестве резервуара Т. cruzi имеют морские свинки, которых население держит дома для употребления в пищу. Естественная зараженность морских свинок достигает 25-60 %.
Болезнь Шагаса широко распространена, ее выявляют практически во всех странах Американского континента от 42о с. ш. до 43о ю. ш. Наиболее часто инфекцию регистрируют в Бразилии, Аргентине, Венесуэле. Она встречается также в Боливии, Гватемале, Гондурасе, Колумбии, Коста-Рике, Панаме, Парагвае, Перу, Сальвадоре, Уругвае, Чили, Эквадоре.
Патогенез и клинические проявления. Т. cruzi паразитируют и размножаются в организме человека и позвоночного хозяина сначала в макрофагах кожи и подкожной клетчатки, затем в регионарных лимфатических узлах, далее - во всех органах.
У некоторых больных, инвазированных Т. cruzi (более часто у детей раннего возраста), развивается острый специфический менингоэнцефалит с мононуклеарной инфильтрацией мягких мозговых оболочек, периваскулярными воспалительными реакциями, иногда в сочетании с геморрагией и пролиферацией глии.
Серьезно страдают структуры ганглиев вегетативной нервной системы, что приводит к расстройствам иннервации внутренних органов.
Считается, что инкубационный период при американском трипаносомозе колеблется от 1 до 2 нед. В месте инокуляции паразитов возникает воспалительная реакция - шагома. В случае проникновения паразитов через кожу первичное местное воспаление напоминает ненагнаивающийся фурункул.
Среди общих симптомов необходимо указать на лихорадку постоянного или ремиттирующего типа с повышением температуры тела до 39-40оС, общую аденопатию, гепатоспленомегалию, отеки, иногда макулезные высыпания. Эти клинические симптомы возникают на фоне острого миокардита и раздражения менингеальной оболочки. Такая симптоматика, как правило, наблюдается у детей в эндемичных районах, при этом тяжесть течения увеличивается с уменьшением возраста больного. Примерно 10 % случаев заканчиваются летально в результате прогрессирующего менингоэнцефалита или тяжелого миокардита с сердечной недостаточностью.
После острого периода болезнь переходит в хроническую стадию.
Диагностика. В острой стадии паразитов легко обнаруживают путем микроскопии препаратов периферической крови. Наряду с окрашенными фиксированными препаратами можно исследовать раздавленную каплю крови, при этом подвижные паразиты хорошо видны под микроскопом. В хронической стадии микроскопия малоэффективна.
В целях диагностики прибегают к серологическим реакциям, чаще к реакции связывания комплемента с антигеном из пораженного трипаносомами сердца. Широкое распространение в эндемичных районах получила ксенодиагностика - кормление незараженных триатомовых клопов на больном с последующим исследованием экскрементов насекомых для обнаружения паразитов.
Профилактика. К профилактическим мерам относятся применение стойких контактных инсектицидов для уничтожения клопов-переносчиков, благоустройство жилищ. В связи с наличием бессимптомных носителей в эндемичных районах обязательно обследование доноров серологическими методами и с помощью ксенодиагностики.
Род Leishmania (лейшмании). Простейшие рода Leishmania вызывают лейшманиозы - облигатно-трансмиссивные заболевания.
Жизненный цикл лейшманий (рис. 2.15) протекает со сменой хозяев и включает две морфологические формы - амастиготную (безжгутиковую) и промастиготную (жгутиковую). У теплокровных амастиготы и микромастиготы лейшманий обнаруживают в протоплазме клеток ретикулоэндотелиальной системы, способных к фагоцитозу. Они имеют вид мелких овальных или круглых телец длиной от 2 до 5 мкм (рис. 2.16).
В амастиготной форме лейшмании паразитируют в клетках (макрофагах) природных резервуаров (позвоночные животные) и человека, в промастиготной - обитают в различных частях пищеварительного тракта москитов, которые служат их переносчиками, и в питательных средах. Промастиготы лейшманий имеют удлиненную веретеновидную форму; их длина составляет 10-20 мкм, ширина - 3-5 мкм. Их ядро, протоплазма и кинетопласт окрашены так же, как и у амастигот. В культурах промастиготы часто представляют собой скопления в виде розеток со жгутиками, обращенными к центру (явление агломерации) (рис. 2.17).
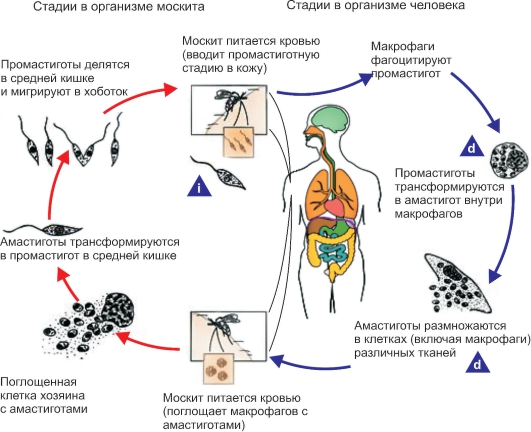
Рис. 2.15.Жизненный цикл Leishmania.
i - инфекционная стадия; d - диагностическая стадия.
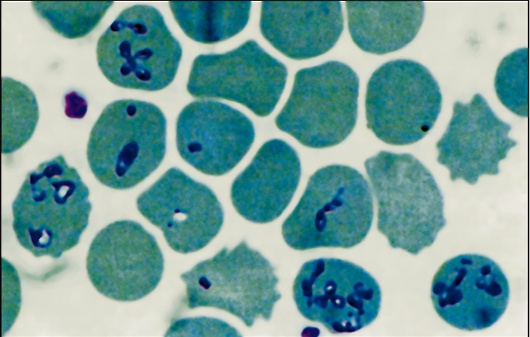
Рис. 2.16.Амастигота (лейшманиальная форма) лейшманий в клетках хозяина.
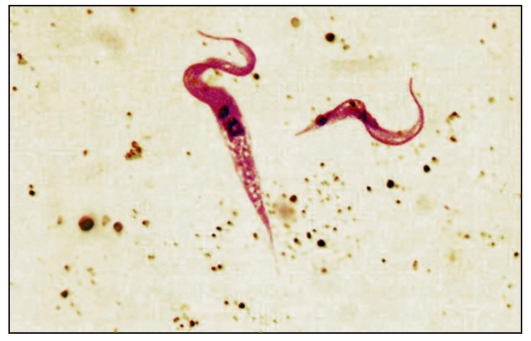
Рис. 2.17.Промастиготы лейшманий в культуре.
Переносчиками лейшманий являются двукрылые насекомые: в Старом Свете - москиты рода Phlebotomus, в Новом Свете - москиты родаLutzomyia. Основные природные резервуары - грызуны и представители семейства псовых.
Лейшманиозы распространены в странах с жарким и теплым климатом. Заболевания людей зарегистрированы в 76 странах Азии, Африки, Южной Европы, Центральной и Южной Америки. Во многих странах лейшманиозы наносят существенный социально-экономический ущерб. В России местные случаи заболевания в настоящее время отсутствуют, однако ежегодно регистрируют завозные случаи среди заразившихся при посещении стран ближнего и дальнего зарубежья, эндемичных по лейшманиозам.
Различают три клинические формы лейшманиоза: кожный, слизистокожный и висцеральный лейшманиозы. При кожном лейшманиозе поражаются кожные покровы; при слизисто-кожном - кожа и слизистые оболочки, главным образом верхних дыхательных путей, иногда с разрушением мягких тканей и хрящей; при висцеральном лейшманиозе возбудитель
локализируется в печени, селезенке, костном мозге и лимфатических узлах. В России чаще всего регистрируют кожный и висцеральный лейшманиозы.
Молекулярные и генетические исследования патогенеза лейшманиоза. Патология, возникающая в результате инфекцииLeishmania, в значительной мере зависит от генетических факторов хозяина. Чувствительность к Leishmania donovani, Salmonella typhimurium и Mycobacterium bovis контролируется одним и тем же геном на хромосоме 1 у мышей. Этот ген (NRAMP1) кодирует белок-1, ассоциированный с устойчивостью к лейшманиозу у мышей и человека. Слизистый лейшманиоз как осложнение кожного лейшманиоза ассоциирован с аллельными генами, кодирующими цитокины (фактор некроза опухоли). Эти цитокины связываются с одним из двух рецепторов фактора некроза опухоли. Мыши, у которых отсутствовал рецептор, не излечивались от кожных язв, несмотря на то что были способны контролировать размножение паразита. Для заболеваний, при которых клеточный иммунитет играет решающую роль, характерно участие главного комплекса гистосовместимости. В экспериментах на мышах было показано, что различные главные комплексы гистосовместимости были ассоциированы с разной чувствительностью к висцеральному лейшманиозу. Важная роль главного комплекса гистосовместимости в развитии кожного лейшманиоза установлена для человека и подтверждена при анализе генетического сцепления на мышах.
В исследованиях был выявлен локус на хромосоме 1 мыши, который контролирует быстрое размножение Leishmania donovani у этих животных. Несколько групп исследователей выполнили большую работу на иммунологическом и генетическом уровнях и идентифицировали новый ген на хромосоме 1 мыши, который имел локусы lsh, bcg, ity. Этот ген белка-1, ассоциированного с природной устойчивостью макрофаговNRAMP1 (natural resistance-associated macrophage protein-1), локализован на мембране фаголизосом и является транспортером двухвалентных катионов. По-видимому, влияние этого белка на концентрацию Fe+ в вакуоли играет определенную роль в образовании кислородных радикалов в фаголизосоме. Исследования лейшманиоза на мышах.
Дата добавления: 2016-12-27; просмотров: 6658;











