Абсорбционная спектрофотометрия.
Спектроскопические методы
Для исследованиясвойств биологических систем и макромолекул широко применяют различные спектроскопические (спектральные, оптические) методы, т.е. методы, основанные на взаимодействии молекул со светом. Оптические методы используются для изучения стационарных характеристик биологических объектов, когда за время измерения не происходит изменений регистрируемых параметров. Они также используются для измерения и динамических параметров, изменяющихся во времени в процессе их регистрации, вследствие протекания в системе нестационарных процессов.
Световая (электромагнитная) волна представляет собой колебания электрического и магнитного полей во взаимно перпендикулярных плоскостях, амплитуды колебания которых по мере распространения волны изменяются по синусоиде (рис.1). Энергия волны
Е = hc/l = hn,
где h - постоянная Планка, с - скорость света, l - длина волны, n - частота волны.
Когда световая волна сталкивается с молекулой, она может либо преломляться (т.е. изменять направление распространения), либо поглощаться (т.е. энергия волны передается молекуле).
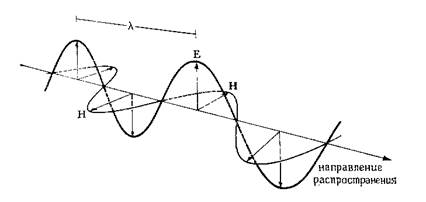
Рис. 1. Схематичное изображение поляризованной световой (электромагнитной) волны
Относительная вероятность протекания того или иного процесса является свойством той молекулы, с которой произошло столкновение. Если произошло поглощение электромагнитной энергии, о молекуле говорят, что она возбуждена или перешла в возбужденное состояние. Поглощение и излучение энергии световой волны происходит определенными порциями, квантами. Интенсивность излучения светового потока I = nE (n - число квантов в световом потоке). Энергия кванта связана с длиной волны (нм) следующими соотношениями: EДж = 1,2 ·108/l, EэВ = 1234/l, где Eдж выражена Дж/моль, EэВ - в электрон-вольтах.
Молекула или часть молекулы, которая может быть возбуждена при поглощении света в видимой области или УФ-области, называется хромофором. В основном, энергия возбуждения превращается в тепло (кинетическую энергию) в результате столкновения возбужденной молекулы с другой молекулой (например, с молекулой растворителя). При возбуждении некоторых типов молекул поглощенная энергия света вновь излучается в виде фотонов (флоуресценция). В любом случае, интенсивность света, прошедшего через молекулу, содержащую набор хромофоров, меньше интенсивности падающего света. Как известно, молекула (атом) характеризуется набором квантованных энергетических состояний, описываемых законами квантовой механики. Эти состояния называют энергетическими уровнями молекул (атомов). Главный энергетический уровень определяется возможным пространственным распределением электронов и называется электронным энергетическим уровнем. Внутри главного уровня находятся колебательные уровни, характеризующие изменение движения электронов. Колебательные уровни указывают на различные типы колебаний молекул (изменение угла связей, длины связей). Энергетические уровни молекул обычно изображают схемой энергетических уровней (Рис. 2). Самый низкий электронный уровень называют основным состоянием молекулы (атома), а все другие – возбужденными состояниями.
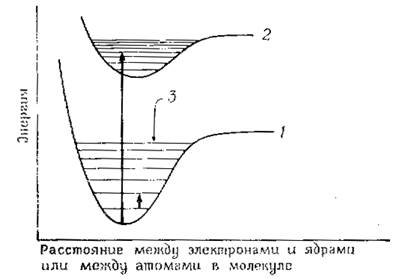
Рис. 2. Схема энергетических уровней распределения электронов
1- основной (S0) электронный уровень; 2 - первый возбужденный (S*1) уровень; 3 - колебательные уровни; 4 - переход с основного уровня на колебательный уровень возбужденного состояния; 5- переход с одного колебательного уровня на другой в пределах одного состояния.
Наибольшая вероятность поглощения энергии электромагнитной волны имеет место в случае, если эта энергия соответствует разности энергий квантованных состояний молекулы. Электромагнитная волна (свет) с длиной волны lпоглощается в том случае, если
l = hc/Е2 – Е1,
где Е1 -значение энергии молекулы до возбуждения (основной энергетический уровень), Е2 -значение энергии возбужденной молекулы ( после поглощения энергии электромагнитной волны).
Изменение энергетического состояния молекулы при поглощении (или испускании) энергии света называется переходом. Переход между электронными уровнями соответствует энергии, необходимой для перемещения электрона с одного уровня на другой. При переходе электрона на более высокий энергетический уровень энергия поглощается, при переходе на более низкий уровень – энергия излучается. Зависимость между поглощением энергии молекулой от длины волны падающего света называется спектром поглощения. Поскольку возможны переходы с основного состояния на любой колебательный или вращательные уровни, то спектр поглощения молекулы выглядит в виде относительно плавной кривой. Каждый тип молекул характеризуется своим, присущим только этой молекуле, спектром поглощения. Для большинства биологических молекул, длины волн, соответствующие переходам между основным состоянием и любым колебательным уровнем первого возбужденного состояния, лежат в ультрафиолетовой и видимой части спектра ( 102 -103 нм) .Возможны также переходы между колебательными уровнями в пределах одного электронного уровня. Такие переходы имеют место в результате поглощения излучения в инфракрасной области спектра (103 - 105 нм). Переходы на вращательном уровне (изменения спина электрона) происходят в области радиочастотного спектра электромагнитных волн ( >105 нм). Как видно из рисунка 3, для характеристики макромолекул в определенном спектре электромагнитных волн применяются различные спектральные методы.
Вероятность поглощения света определенной длины волны молекулами характеризуется молярным коэффициентом поглощения
( погашения, экстинции) e.
Если световой поток с интенсивностью I0 проходит через раствор с толщиной слоя d и концентрацией молекул с,тоинтенсивность прошедшего через раствор света I подчиняется закону Ламберта-Бэра
I = I0 ×10 -edc
или
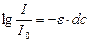 ,или
,или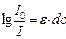 ,
,
где I – интенсивность света (энергия на единицу площади в единицу времени), Дж×м2× с; e - молярный коэффициент поглощения (погашения, экстинции), характеризует вероятность перехода молекулы из одного энергетического состояния в другое при поглощении или испускании кванта света;
d - толщина слоя раствора ( длина кюветы), см;
с - концентрация вещества, моль/л.
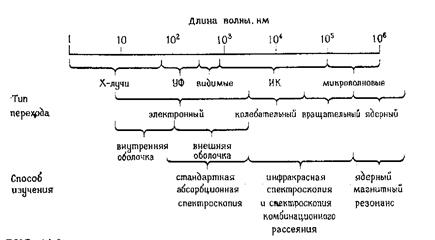
Рис. 3. Схема спектра электромагнитных волн и использование различных спектральных методов анализа макромолекул
Результаты измерений выражают либо как процент пропускания 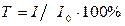 , либо как поглощение
, либо как поглощение 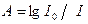 . Когда d = 1см, А называют оптической плотностью Dl = ec. Индекс l указывает на длину волны, при которой проводится измерение. При высоких концентрациях вещества в растворе могут иметь место отклонения от закона Ламберта-Бэра. Это может происходить вследствие рассеяния света, структурных изменений молекул (например, при димеризации, агрегации молекул). Высокие концентрации веществ в растворе могут стимулировать и химические изменения молекул. Поэтому при спектрофотометрическом определении концентрации вещества в растворе, нужно убедиться в соблюдении этого закона в исследуемом интервале концентраций. Например, в случае соблюдения закона, разбавление исследуемого раствора в 2 раза, должно привести к уменьшению значения Dl тоже в 2 раза.
. Когда d = 1см, А называют оптической плотностью Dl = ec. Индекс l указывает на длину волны, при которой проводится измерение. При высоких концентрациях вещества в растворе могут иметь место отклонения от закона Ламберта-Бэра. Это может происходить вследствие рассеяния света, структурных изменений молекул (например, при димеризации, агрегации молекул). Высокие концентрации веществ в растворе могут стимулировать и химические изменения молекул. Поэтому при спектрофотометрическом определении концентрации вещества в растворе, нужно убедиться в соблюдении этого закона в исследуемом интервале концентраций. Например, в случае соблюдения закона, разбавление исследуемого раствора в 2 раза, должно привести к уменьшению значения Dl тоже в 2 раза.
Измерение поглощения света осуществляется при помощи спектрофотометров или фотоколориметров. Несмотря на различия в конструкции, все спектрофотометры (рис. 4) состоят из источника света (1), монохроматора (2), стеклянной кюветы (3), куда помещается исследуемый образец, детектора света (4) и измерительного прибора (5). Ход работы обычно следующий. Прибор настраивают таким образом, чтобы он показывал нулевое значение при измерении поглощения растворителя, в котором растворено исследуемое вещество. Затем можно снимать показания, соответствующие непосредственно поглощению образца. Для получения спектра поглощения операция повторяется при различных длинах волн.
 |
1 2 3 4 5
Рис. 4. Схематичное изображение устройства абсорбционного спектрофотометра
1. источник света (вольфрамовая или дейтериевая лампа);
2. монохроматор;
3. кюветная камера с кюветой;
4. фотоэлемент (детектор света);
5. измерительный прибор.
Абсорбционная спектофотометрия широко используется для определения концентрации растворов, анализа химических реакций, идентификации веществ, определения структурных параметров макромолекул.
1. Определение концентрации растворов проводят непосредственно измерением оптической плотности, если известен eисоблюдается закон Ламберта-Бэра. В большинстве случаев для определения концентрации используют калибровочные графики, составленные по известным концентрациям.
2. Исследование биохимических реакций. Скорость реакции, активность ферментов можно измерить по уменьшению концентрации субстрата или по повышению концентрации продукта реакции в реакционной смеси.
3. Идентификация веществ путем спектральных измерений. Большинство соединений имеют характерные спектры поглощения и могут быть идентифицированы с их помощью. Для этих целей используются автоматические регистрирующие спектрофотометры.
4. Исследование процессов денатурации и ренатурации ДНК. При денатурации ДНК его оптическая плотность D260 повышается, при ренатурации – понижается
Дата добавления: 2018-05-10; просмотров: 2045;











