ОЧИСТКА ГАЗОВ ОТ СЕРООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В промышленных газах присутствуют в основном такие сернистые соединения, как сероокись углерода (COS), сероуглерод (CS2), низкомолекулярные меркаптаны и тиофен. Природный и нефтезаводской газы содержат главным образом меркаптаны, а в некоторых случаях следы сероокиси углерода и тиофена. В каменноугольном и синтез-газах органические сернистые соединения представлены COS, CS2 и тиофеном. Содержание этих соединений изменяется в широких пределах и зависит от процессов переработки, которым газ предварительно подвергался. Органические сернистые соединения значительно менее рекционноспособны, чем H2S; поэтому при обычных процессах извлечения H2S содержание их не снижается или снижается незначительно. Некоторые адсорбционные и окислительные процессы, применяемые для удаления H2S, позволяют частично удалить и органическую серу, но, как правило, для удаления последних необходимо применять каталитические методы превращения при высоких температурах. При большинстве каталитических процессов удаления органической серы требуется, чтобы поступающий газ практически не содержал H2S. Однако при применении некоторых катализаторов присутствие сравнительно значительных количеств H2S не снижает их активности. Такие катализаторы имеют особенно важное экономическое значение при очистке синтез-газов, когда предварительная очистка от H2S для возможности последующего удаления органических сернистых соединений вызывает необходимость охлаждения и повторного нагрева всего количества газа, поступающего на очистку.
7.5.1. Каталитическое гидрирование сероорганических соединений
Гидрирование применяют в тех случаях, когда в газе присутствуют соединения, недостаточно полно удаляемые с помощью поглотителей. К таким соединениям относятся CS2, тиофен и дисульфиды. Очистка газов методом гидрирования основана на каталитическом взаимодействии сероорганических соединений (СОС) с водородом или водяным паром. Процесс взаимодействия с водяным паром обычно называют гидролизом, или конверсией СОС.
Гидрирование и гидролиз СОС сводятся к реакциям образования H2S и соединений, не содержащих серу. Образующийся H2S удаляют из газа известными методами.
Установлено, что гидрирование тиофенов происходит труднее, чем остальных сернистых соединений, а способность индивидуальных соединений серы к реакции гидрирования увеличивается в следующей последовательности: тиофен, меркаптаны жирного ряда, CS2, меркаптаны бензольного ряда, COS:
C4H4S -4 CH3SH -» CS2 -»C6H5SH -»COS.
Наиболее распространенными катализаторами являются соединения на основе железа, кобальта, никеля, молибдена, меди и цинка. Известны также катализаторы на основе благородных металлов.
Состав катализаторов, их активность и другие свойства определяются содержанием в реакционной смеси сернистых соединений и водорода. Все катализаторы, независимо от их исходного состава, в процессе очистки сульфидируются в результате взаимодействия присутствующих в газе сернистых соединений с компонентами катализатора. При этом образуются сульфиды железа, кобальта, никеля и т.п. Установлено, что активность катализатора зависит от наличия в них сульфидов и растворенной серы.
Методами гидролиза и гидрирования термодинамически возможно осуществить тонкую очистку газов от СОС. На практике удается достигнуть 90-99,9 % степени превращения.
Рассмотрим схему очистки природного газа от СОС, применяемую в сочетании с адсорбционным методом.
Газ, содержащий до 40 мг/м3 СОС и 20 мг/м3 H2S, сжатый до давления 40-45.105 Па (40-45 кгс/см2) нагревается до температуры 400 °С в огневом подогревателе, в котором сжигается топливный природный газ. Перед поступлением в подогреватель к газу примешивают водород в виде азот-водородной смеси в количестве до 15 %. В контактном аппарате на алюмокобальтмолибденовом катализаторе при температуре 400 °С происходит превращение СОС в H2S. После аппарата гидрирования газ направляют в адсорбер для очистки от H2S. Содержание СОС после гидрирования не превышает 1 мг/м3. Контактный аппарат может быть полочного и радиального типа.
7.5.2.Адсорбционная очистка сероорганических соединений
Кроме каталитического преобразования СОС часто применяют адсорбционные методы. Различают чистую адсорбцию, т.е. адсорбцию без химической реакции и хемосорбцию, основанную на непосредственном связывании СОС при 200-400 °С твердыми поглотителями.
Адсорбция на активированном угле
На применении активированного угля основаны два способа очистки: адсорбционный и окислительный, преимущество которых заключается в том, что для их проведения не требуется подогрев газа.
Адсорбционный способ заключается в обратимой адсорбции сернистых соединений из газа с последующей их десорбцией путем пропускания пара при 120-150 °С. Легче других адсорбируется тнофен, CS2, плохо адсорбируются COS, дисульфиды.
Исследованы различные марки активированных углей, как отечественного, так и зарубежного производства. Изучены равновесие и динамика многих адсорбционных процессов.
Высокая степень очистки коксового газа от СОС может быть достигнута комбинированием адсорбционного метода с очисткой от COS (например, каталитическим или поглотительным методом).
Преимуществом адсорбционного метода является возможность практически полного удаления тиофена. Одновременно с соединениями серы удаляются остатки тяжелых УВ (нафталина и др.), затрудняющих адсорбцию серосодержащих примесей.
Обработка угля водяным паром при 120-150 °С обеспечивает его регенерацию, однако, от цикла к циклу емкость угля постепенно снижается вследствие накопления на его поверхности продуктов осмоле- ния и полимеризации. В присутствии H2S в коксовом газе количество недесорбируемых веществ на угле увеличивается, поэтому необходимо предварительная очистка газа от H2S.
Активированный уголь был применен также для очистки природного и генераторного газов.
Для удаления меркаптана и COS предложено использовать активированный уголь с добавками металлов (никель, железо) или оксидов металла.
Адсорбция активированным углем находит широкое применение в области очистки отходящих газов вискозных производств.
Комбинированный метод очистки вентиляционных газов производства химических волокон от H2S и CS2
Выбросы CS2 в атмосферу непосредственно связаны с развитием промышленности химических волокон. Например, комбинат химво- локна, выпускающий 50 т кордного, 150 т штапельного и 20 т целлофанового волокна выбрасывает в атмосферу в сутки 35 млн. м3 вентвоз- Духа, который содержит Ют H2S и 56 т CS2.
Во всех случаях CS2 улавливают с помощью активного угля. Большую часть H2S в некоторых схемах удаляют жидкими поглотителями. Трудность использования активного угля для очистки от обоих компонентов долгое время заключалась в том, что при улавливании H2S углем в присутствии кислорода основная реакция преобразования адсорбата в серу сопровождается сильно экзотермическим процессом образования серной кислоты:
2H2S + 02 -» 2S + 2Н20 + 220 кДж;
H2S + 202 -» H2S04 + 790 кДж.
Удельный вес побочных реакции, протекающих в порах активированных углях настолько значителен, что при высокой концентрации H2S слой угля сильно разогревается и возникает опасность возгорания CS2.
Абсорбционная стадия не решает проблему полного извлечения H2S; его концентрация в газе после абсорбера 20-50 мг/м3.
Новые технические проекты предусматривают совмещенную очистку H2S и CS2.
Схема совмещенного метода очистки вентвыбросов от H2S и CS2, разработанная западногерманской фирмой Пинч-Бамаг, приведена на рис.7.3.
Воздух, содержащий примеси, с помощью воздуходувки 9 пропускают через один или несколько параллельно включенных адсорберов 8. К воздуху примешивают аммиак. H2S окисляется в лобовом слое угля, при этом в порах отлагается сера. Одновременно происходит физическая адсорбция CS2. Очищенный воздух выбрасывается в атмосферу через трубу. В 1 м3 очищенного воздуха содержится 10-20 мг CS2 и 1-2 мг H2S. На стадии очистки концентрацию CS2 непрерывно измеряют газоанализатором, и в момент “проскока” поток воздуха автоматически переключается на адсорбер с отрегенерированным углем, а адсорбер 8 переключается на стадию регенерации.
Смесь CS2 с воздухом взрывоопасна уже при 80 °С, и поэтому перед десорбцией адсорбер продувают инертным газом до тех пор, пока концентрация кислорода не упадет ниже границы взрываемости CS2.
Десорбцию проводят острым паром. Смесь паров CS2 и воды конденсируют в конденсаторе 11 и дополнительно охлаждают до 25 °С в холодильнике12. В сепараторе 14 жидкая фаза разделяется ввиду разницы плотностей. Нижний сероуглеродный слой является высококачественным товарным продуктом; воду направляют в канализацию.
Сушку и охлаждение угля проводят воздухом, подаваемым воздуходувкой 13. На стадии сушки воздух подогревают до 120 °С в паровом нагревателе 10. На стадии охлаждения подачу пара в нагреватель прекращают или воздух пропускают по байпасу мимо нагревателя.
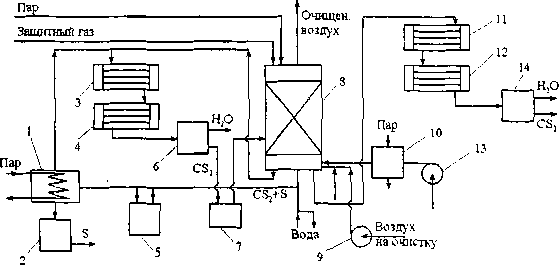 Рис. 7.3. Схема совмещенного метода очистки вентиляционных выбросов от сероводорода и сероуглерода
/ - испаритель сероуглерода; 2,5,7 - емкости; 3,11 - конденсаторы; 4,12 - холодильники; 6,14 - сепараторы; 8 - адсорбер; 9,13 - воздуходувки; 10 - нагреватель
Рис. 7.3. Схема совмещенного метода очистки вентиляционных выбросов от сероводорода и сероуглерода
/ - испаритель сероуглерода; 2,5,7 - емкости; 3,11 - конденсаторы; 4,12 - холодильники; 6,14 - сепараторы; 8 - адсорбер; 9,13 - воздуходувки; 10 - нагреватель
|
Периодически адсорбер отключают от основного рабочего цикла и отмывают сернистые соединения из угля. Сначала водой удаляют аммонийные соли, а затем CS2 из емкости 7 - элементарную серу. Вы-' ходящий из адсорбера CS2, содержащий растворенную серу, собирают в емкости 5, затем испаряют (1), конденсируют (3), охлаждают (4) и после отделения от воды в сепараторе 6 собирают в емкости 7.
Хемосорбция сероорганических соединений
Хемосорбция основана на непосредственном связывании СОС твердыми поглотителями. Принципиальная схема процесса состоит из двух стадий: нагревания газа и поглощения серы. Тепло газа может быть использовано при его дальнейшей переработке. Для приготовления поглотителей используются оксиды цинка, железа, меди.
Поглощение СОС оксидом цинка описывается следующими реакциями:
2ZnO + CS2 = 2ZnS + С02;
ZnO + COS = ZnS + C02;
ZnO + C2H5SH = ZnS + C2H5OH.
Термодинамические расчеты показывают, что реакции поглощения СОС оксидом цинка при 400-450 °С практически необратимы, следовательно, возможна полная очистка газов от этих соединений.
Разработанный на основе оксида цинка поглотитель ГИАП-10 не требует предварительной подготовки (восстановления, активации и др.). На его сероемкость не влияет содержание серы в газе. Полнота очистки зависит лишь от характера этих соединений. H2S, COS, CS2 и меркаптаны полностью удаляются поглотителем ГИАП-10; хуже поглощается тиофен и органические сульфиды. Для протекания процесса очистки не обязательно содержание водорода в газе, при его наличии возможна еще более тонкая очистка за счет гидрирования высших органических соединений серы.
Регенерация поглотителя заключается в окислении сульфида цинка кислородом при 500 °С. Сероемкость поглотителя после регенерации снижается на 2-3 %. Степень очистки регенерированным поглотителем такая же, как свежим.
Разработан низкотемпературный поглотитель ГИАП-10-2 на основе оксида цинка с активирующей добавкой оксида меди, что позволяет снизить температуру процесса очистки до 300°. При этом уменьшается возможность зауглероживания поглотителя при очистке газов с повышенным содержанием тяжелых УВ.
Для тонкой очистки водяного газа в качестве поглотителя СОС применяют железосодовую массу, приготовленную на основе активного оксида железа с добавлением 30 % соды.
Железосодовая масса поглощает COS, CS2, меркаптаны (тиофен не поглощается). При этом образуются сульфаты, сульфиды и элементная сера, одновременно выделяется углерод.
Учитывая малую сероемкость и невозможность регенерации поглотителя, этот метод целесообразно применять для очистки газов с невысоким содержанием органической серы.
7.5.3. Абсорбционные методы очистки сероорганических соединений
В ранее рассмотренных процессах физической абсорбции (спосо- бы“Пуризол”, “Селексол”, “Ректизол”), а также совместно химическими и физическими абсорбентами (процесс “Сульфинол”) предусмотрена комплексная очистка от сероводорода, диоксида углерода и сероорганических соединений.
Рассмотрим некоторые процессы абсорбционной очистки газов от сероорганических соединений.
Щелочная очистка от меркаптанов
Очистка от меркаптанов водным раствором щелочей основана на реакции:
NaOH + RSH <=> NaRS + Н20.
При длительном контакте со щелочью, особенно в присутствии кислорода и С02, образуются и другие продукты. Например, меркаптаны могут окисляться до дисульфидов и полисульфидов, плохо растворимых в щелочи:
4RSH + 02 -» 2 R-S-S-R + 2Н20.
При дальнейшем окислении меркаптанов образуются сульфокислоты R-02S- ОН.
В присутствии С02 при нагревании могут образовываться тиокар- боновые кислоты 0= RC- SH.
Низшие меркаптаны хорошо растворяются в щелочи, но с увеличением их молекулярного веса растворимость уменьшается.
Технологическая схема щелочной очистки от меркаптана в основном не отличается от схемы МЭА очистки от С02.
Десорбция этилмеркаптана обеспечивается отдувкой паром при кипячении или каким-либо газом при нагревании, а также воздухом без дополнительного нагрева. Регенерация сорбента выполняется в наса- дочных башнях или тарельчатых аппаратах.
При правильном выборе аппарата процесс щелочной очистки экономичен. Однако, если концентрация С02 в газе выше 0,1-0,3 %, чрезмерно возрастает расход щелочи. Для больших концентраций С02 рекомендуется двухступенчатая схема: первая ступень - МЭА очистка, вторая - щелочное поглощение меркаптана. В этом случае расход соды не превышает 0,16 кг на 1000 м3 природного газа.
Процесс эффективен также при тонкой очистке других газов, например, коксового.
Известен также процесс абсорбции COS и CS2 щелочным раствором:
CS2 + 2NaOH -»COS + Na2S + H20;
COS + 4NaOH -»Na2S + Na2C03 + 2H20.
Реакции необратимы, но протекают медленно, поэтому в отличие от меркаптанов для увеличения скорости реакции процесс необходимо вести при температуре 60-80 °С.
Таким образом, при наличии в газе разнообразных сернистых соединений, необходима двухступенчатая - холодная и горячая очистка.
Недостатком процесса является невозможность удаления дисульфидов и тиофена.
ГЛАВА 8. ОЧИСТКА ГАЗОВ ОТ ОКСИДОВ АЗОТА
Оксиды азота являются одними из основных загрязнителей атмосферы. Следует знать, что азот с кислородом образует следующие соединения: n2o, no, no2, n2o4, n2o3, N2Os.
Источниками оксидов азота, поступающих в атмосферу, служат газы, образующиеся при сжигании топлив в стационарных установках; выхлопные газы двигателей внутреннего сгорания; отходящие газы производства азотной кислоты; газы, образующиеся при получении катализаторов и различных солей, а также при травлении металлов и проведении ряда других процессов.
Из общего количества оксидов азота, выбрасываемых в атмосферу, в настоящее время около 60 % приходится на долю стационарных установок сжигания топлив, до 39 % на долю автотранспорта и до 2 % - на долю отходящих газов химических производств.
Существующие методы уменьшения концентрации оксидов азота в отходящих газах промышленных предприятий подразделяются на первичные и вторичные. Первичные методы снижения образования оксидов азота - совершенствование технологий, при осуществлении которых происходит эмиссия загрязнителей в окружающую среду. В энергетике, например, - это рециркуляция дымовых газов, улучшение конструкций горелок, регулирование температуры дутья. Ко вторичным относятся методы удаления оксидов азота их отходящих газов (дымовых, выхлопных, вентиляционных).
8.1. Окислительные методы очистки
Оксид азота NO является несолеобразующим, индефферентным соединением и трудно вступает в реакцию с большинством известных поглотителей. Для более полного извлечения оксидов азота из газовых смесей производят предварительное окисление NO в NOz и N203. В промышленности используется метод гомогенного окисления N0 в N02 в газовой фазе с помощью кислорода;
2NO + 02 = 2NOz;
NO + N02 = N203.
При низких концентрациях NO (в нитрозных газах производства разбавленной азотной кислоты) скорость окисления оксида азота в газовой фазе очень мала. Это приводит к необходимости установки громоздких и дорогостоящих окислительных объемов. С целью интенсификации процессов в нитрозный газ добавляют кислород до его содержания 8-10 %. Причем большая часть кислорода, не вступив в реакцию, выбрасывается в атмосферу. Остаточное содержание оксидов азота при абсорбционных методах очистки газов составляет 0,05 %. Дальнейшая интенсификация процесса окисления возможна за счет увеличения скорости окисления NO в жидкой фазе, либо в присутствии катализаторов.
8.1.1. Окисление оксида азота газообразным кислородом в жидкой фазе
Показано, что в процессе абсорбции оксидов азота различными поглотителями происходит окисление оксида азота не только в газовой фазе, но и в жидкой. Это дает большие преимущества, т.к. количество жидкой фазы в процессе массопередачи гораздо меньше газовой, в связи с чем технологические операции с жидкостью можно проводить в значительно меньших реакционных объемах.
Разработан метод очистки газов от оксидов азота, в основу которого положен принцип окисления оксида азота в жидкой фазе.
Одним из поглотителей оксидов азота является вода. Процесс абсорбции оксидов азота водой связан с образованием азотной кислоты. Степень абсорбции оксидов азота водой зависит от типа применяемого аппарата и колеблется в пределах 40-80 %.
Основным видом аппаратуры для поглощения оксидов азота являются абсорбционные насадочные колонны, аппараты с ситчатыми тарелками с пенным контактом фаз, аппараты барботажного типа, механические абсорберы с низко- и высокотемпературными режимами, распылительные аппараты типа труб Вентури и аппараты с различными механическими распылителями. Наиболее широкое применение получил агрегат из двух колонн.
Отличительной особенностью агрегата является то, что параллельно с основной абсорбционной ситчатой колонной устанавливается дополнительная колонна малого диаметра, имеющая такое же количество тарелок, как и основная колонна (рис. 8.1).
Конденсат, предназначенный для абсорбции оксидов азота, предварительно поступает на верхнюю тарелку вспомогательной колонны. Здесь он насыщается кислородом, циркулирующим в замкнутом цикле вспомогательной колонны. Насыщенный кислородом конденсат поступает на верхнюю тарелку основной колонны. Здесь он абсорбирует из нитрозных газов оксиды азота, после чего через сливной порог вновь поступает на вторую (сверху) тарелку вспомогательной колонны. На этой тарелке конденсат вновь насыщается кислородом, и цикл повторяется снова на всех тарелках колонны. Так как кислота, поступающая с тарелок вспомогательной колонны на тарелки основной колонны, насыщена кислородом, то на них интенсивно протекает реакция окисления оксида азота в жидкой фазе. Окисление NO в газообразной фазе осуществляется параллельно в межтарельчатом пространстве основной колонны. В связи с этим полнота абсорбции оксидов азота увеличивается.
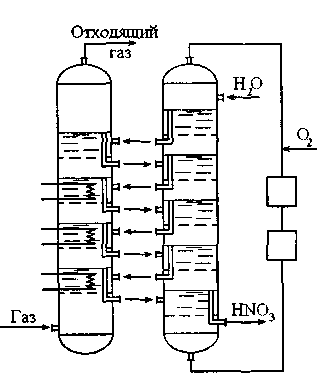 Рис. 8.1. Окисление оксидов азота в жидкой фазе
Рис. 8.1. Окисление оксидов азота в жидкой фазе
|
В таких системах кислород циркулирует в замкнутом контуре дополнительной колонны и расходуется только на окисление NO. Если в циркулирующий кислород добавить 2-3 % азота, то концентрация HN03 может быть увеличена до 60-65 %.
При окислении NO в жидкой фазе является перспективным использование озона. В этом случае в реакции окисления полезно используются все три атома кислорода:
2NO + 03 + Н20 = 2HN03.
Расход окислителя невелик, так как он циркулирует-в системе.
8.1.2. Окисление и абсорбция оксидов азота жидкими окислителями
Процесс окисления NO в жидкой фазе лимитируется диффузией кислорода в раствор, которая протекает очень медленно. Скорость диффузии газообразных окислителей в жидкую фазу зависит от многих факторов: температуры, давления, концентрации компонентов, турбулентности потоков и т.д. Чтобы увеличить скорость окисления NO в жидкой фазе, необходимо воздействовать на систему изменением одного или нескольких перечисленных параметров. Кроме рассмотренных способов, скорость реакции можно увеличить, если ее проводить в жидкой фазе с помощью жидких окислителей. В этом случае окислители находятся в растворенном состоянии, и скорость реакции гомогенного окисления NO в жидкой фазе не будет зависеть от скорости диффузии окислителей в раствор. Таким образом устраняется наиболее медленная стадия процесса.
Известен ряд жидких окислителей, превосходящих по своей активности кислород. К ним относятся водные растворы Н2О2, КМп04, КВЮ3, Na2Cr04, K2Cr207, HN03 и т.д.
Взаимодействие NO с жидкими окислителями в зависимости от условий реакции протекает по следующим суммарным уравнениям: КВг03 + 2NO + Н20 -> 2HNO, + КВг;
КВЮз + 2NO + 2NaOH -> КВг + 2NaN03 + Н20;
ЗН202 + 2NO -> 2HN03 + 2НгО;
ЗН202 + 2NO + 2NaOH -» 2 NaN03 + 4Н20;
КМп04 + NO —» KNO, + МпО;
КМп04 + 3NO + 2NaOH -> Мп02 + 2NaN02 + KN02 + Н20.
На основании экспериментальных данных установлен ряд активности:
КВгОз > HNO3 > КМп04 > Н202 > Na2Cr04 > К2Сг207;
1,0 0,59 0,54 0,33 0,097 0,045.
Таким образом, окислительная способность различных окислителей значительно отличается и многие из них для практических целей не используются.
8.2. Каталитическое восстановление оксидов азота
Наиболее эффективным способом обезвреживания нитрозных газов производства разбавленной азотной кислоты является каталитическое восстановление оксидов азота до элементного азота. Процесс восстановления протекает на поверхности катализатора в присутствии газа - восстановителя. Катализаторами служат сплавы из металлов платиновой группы: палладий, рутений, платина, родий, либо более дешевые составы, содержащие никель, хром, медь, цинк, ванадий, церий и др. элементы.
Эффективность процесса каталитического восстановления оксидов азота определяется прежде всего активностью применяемого катализатора. Наиболее высокой каталитической активностью обладают катализаторы на основе платины, радия и палладия, содержание которых в катализаторах колеблется в пределах 0,1-2 % (масс.). Эти катализаторы обеспечивают высокую степень очистки газа - остаточное содержание оксидов азота в газе не превышает 5-10' % (при объемных скоростях от 20000 до 120000 ч'1).
В качестве носителей для катализаторов используют оксид алюминия, керамику, силикагель, металлическую ленту и др. материалы.
В зависимости от характера восстановителя каталитические методов могут быть по отношению к оксидам азота селективными и неселективными. В последнем случае в качестве восстановителей могут быть использованы метан, карбоксид, водород, природный газ, пары керосина, нефтяной и коксовый газ, азотоводородная смесь. Любой из этих газов, равно как и нитрозный газ, не должен содержать примесей сернистых соединений, вызывающих отравление катализаторов.
При применении в качестве восстановителя аммиака протекает процесс селективного каталитического восстановления оксидов азота в отходящих газах Аммиак реагирует только с оксидами азота, восстанавливая их до безвредных веществ и не взаимодействует при этом с кислородом, в связи с чем аммиак расходуют в количествах, эквивалентных содержанию в обезвреживаемых газах оксидов азота. При этом поддерживается температура в пределах 200-300 °С.
Восстановление оксидов азота протекает по схеме (все эти процессы экзотермичны):
4NO + СН4 -> 2N2 + С02 + 2НгО;
2N02 + СН4 -> N2 + С02 + 2Н20;
2NO + 2СО -> N2 + 2С02;
2N02+ 4СО -> N2 + 4С02;
2NO + 2Н2 -> N2 + 2Н20;
2N02 + 4Н2 -> N2 + 4Н20.
Каталитическое восстановление оксидов азота начинается при температуре 149 °С в случае применения водорода в качестве восстано
пользуются отечественные марки катализаторов на основе палладиро- ванной окиси алюминия.
Схема каталитической очистки газов приведена на рис. 8.2.
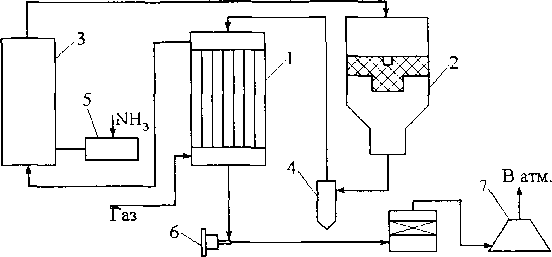 Рис. 8.2. Схема каталитической очистки отходящих нитрозных газов производства разбавленной азотной кислоты
1 - подогреватель; 2 - реактор; 3 - смеситель: 4 - циклон; 5 - испаритель; 6 - турбокомпрессор, 7 - реактор конверсии СО
Рис. 8.2. Схема каталитической очистки отходящих нитрозных газов производства разбавленной азотной кислоты
1 - подогреватель; 2 - реактор; 3 - смеситель: 4 - циклон; 5 - испаритель; 6 - турбокомпрессор, 7 - реактор конверсии СО
|
Хвостовые нитрозные газы, содержащие 0,2 % оксидов азота, 3 % кислорода, 2 % воды (остальное составляет азот), проходят подогреватель хвостовых газов 1, при этом их температура повышается до 260- 280 °С за счет тепла отходящих газов. Перед поступление в реактор 2 добавляют аммиак из испарителя 5 в смеситель 3. Хвостовой газ в смеси с аммиаком входит в реактор, внутри которого установлена катали- заторная корзина. На катализаторе происходит разложение оксидов азота. Температура газовой смеси за счет тепла реакции повышается до 800 °С.
6NO + 4 NH3=5N2 + 6Н20 + Q;
6N02 + 8NH3 =7N2 + 12Н20 + Q.
Очищенный от оксидов азота (0,005 %), но содержащий оксид углерода газ при температуре 800 °С проходит теплообменник 3 и циклон 4 (температура газа при этом снижается до 450-520°). Для более полного протекания реакций содержание NH3 должно превышать стехиометрическую норму на 20-30 %. Избыток NH3 окисляется кислородом по реакции:
4NH3 + ЗО3 = 2N2 + 6Н20 + Q.
Затем газ проходит межтрубное пространство подогревателя хвостовых газов 1, нагревая хвостовой неочищенный газ др температуры контактирования, и направляется в турбину воздушного турбокомпрессора 6, где рекуперируется энергия газа. Так как в газе содержится 0,20-0,5 % оксида углерода, его следует очищать от СО.
При температуре 170-180 °С очищенный от NO газ поступает в реактор 7 низкотемпературной конверсии СО.
Метод обеспечивает степень очистки нитрозных газов не менее
99%.
К недостаткам каталитических методов очистки газов от оксидов азота следует отнести дороговизну и дефицитность используемых катализаторов. Кроме того, каталитические методы восстановления приемлемы для систем, в отходящих газах которых содержится не более 0,5 % оксидов азота, а содержание кислорода не превышает 4-5 % и отсутствуют соединения серы. Каталитические методы очистки не позволяют утилизировать оксиды азота, что приводит к потере ценного химического сырья.
8.2.1. Термические методы разложения
Восстановление оксидов азота возможно без катализаторов под действием высоких температур в присутствии восстановителей.
Полное разложение оксидов азота происходит при температуре 6000-1000 °С.
Разложение оксидов азота по схеме 2NO = N2 + 02 можно сдвинуть в правую сторону, если связывать образующийся кислород.
Для этой цели используют газообразные, жидкие и твердые восстановители. Из газообразных восстановителей изучено влияние на скорость процесса природного газа, водорода, оксида углерода. Из жидких - керосин и бензин. В качестве твердых восстановителей - кокс, графит, уголь.
Разложение оксидов азота в потоке низкотемпературной плазмы
Жидкие и газообразные восстановители вводились в реакционную зону плазмотрона при температуре 2000 °С.
На первой стадии разложения оксидов азота, независимо от рода восстановителя, протекают реакции:
2N02= NO + 02;
2N0 = N2 + 02.
Вторая стадия при использовании водорода:
2 Н2+ О 2 = 2Н20;
2 Н2 + 2 NO = 2 Н20 + N2.
При использовании NH3:
4 NH3 + 30 2= 2 N2+ 6 H 20;
4 NH3 + 6NO= 5 N2+ 6 H 20.
Если без восстановителей степень разложения 5%-го нитрозного газа 46 %, то в присутствии водорода - до 90 %, аммиака - до 93 %.
Остаточное содержание NO в процессе очистки - 0,05 - 0,1 %, поэтому метод применим для систем, выбрасываемых в атмосферу не более 10000-20000 м3/ч газа. При больших объемах он не обеспечивает
нормативных показателей. Аналогичные результаты получаются при
использовании жидких восстановителей.
Иначе ведут себя твердые восстановители:
С + 02=С02;
С + 2NO = С02+ N2.
Процесс разложения на коксе начинается при температуре 500 °С, при 1000 °С степень разложения 100 %.
Разложение оксидов азота в термическом реакторе
Процесс разложения оксидов азота можно вести эффективно при температуре 900-1100 °С. Для нагрева газа до таких температур можно использовать обычное энергетическое сырье (природный газ).
На этой основе разработан комбинированный метод санитарной очистки газов, суть которого состоит в следующем: на первой стадии происходит нагрев газа в реакторе до температуры 900-1000 °С за счет сжигания природного топлива. При этом происходит разложение основного количества оксидов азота и связывание кислорода. На второй стадии остатки оксидов азота полностью восстанавливаются по действием твердого восстановителя - кокса. Метод предусматривает утилизацию тепла, что повышает его ТЭП. В результате степень термического разложения оксидов азота достигает 99,5 %, а остаточное содержание NO в газе 0,01 %. Это позволяет применить метод очистки для систем с большим объемом выбрасываемых газов (до 60 тыс. м3/ч).
8.3. Поглощение оксидов азота щелочными и селективными
СОРБЕНТАМИ
Щелочные поглотители
Щелочными растворами поглощаются высшие оксиды азота - N203, NO, N205. Оксид азота NO следует предварительно окислять до N02 не менее чем на 50 %. В роли поглотителей выступают растворы гидроокиси натрия, карбоната натрия, гидроокиси калия, гидроокиси кальция, гидроокиси аммония, карбоната магния и др. Наиболее широ-
кое распространение получили растворы карбоната натрия и гидроокиси кальция Са(ОН)2.
При поглощении оксидов азота раствором Na2C03 протекают реакции:
N203 + Na2C03 = 2NaNOz + С02;
2N02 + Na2C03 = NaN02 + NaN03 + C02.
В случае применения раствора Са(ОН)2 происходят реакции:
N203 + Са(ОН)2 = Ca(N02)2 + Н20;
4N02 + 2Са(ОН)2 — Ca(N02)2 + Ca(N03)2 + 2Н20.
При поглощении оксидов азота раствором аммиака образуются соединения с низкими температурами разложения:
N203 + 2NH4OH = 2NH4N02 + Н20;
2N02 + 2NH4OH = nh4no2 + nh4no3 + н2о.
Нитрит аммония неустойчив и при температуре выше 56 °С полностью разлагается на азот и воду:
56°С
NH4NO2 ►Иг + 2Н2
230°С
NH4NO3 ^N2 + 2НгО + 1/202
Основная часть оксидов азота связывается в нитрит аммония, к тому же взаимодействие оксидов азота с аммиаком и разложение нитритов и нитратов сопровождается выделением значительного количества тепла, что снижает расход энергии на поддержание температуры в реакторе. При определенной концентрации оксидов азота в газе процесс может протекать автотермично без подвода тепла извне.
Преимущество этого метода состоит в том, что благодаря низким температурам процесс взаимодействия аммиака с оксидами азота протекает избирательно, без вовлечения в реакцию кислорода, на что потребовалось бы вводить дополнительное количество газа- восстановителя. Этот простой и дешевый метод применим для систем с большим объемом выбрасываемых газов и низким содержанием в них оксидов азота.
Аналогично протекают процессы взаимодействия оксидов азота с другими щелочными компонентами.
Для поглощения оксидов азота абсорбционными методами наибольшее распространение в промышленных условиях получили абсорбционные башни - вертикальные цилиндрические аппараты. Менее распространены барботажные абсорберы и полые башни.
Для поглощения оксидов азота суспензиями Са(ОН)2, Mg(OH)2 рекомендуются механические абсорберы с высокотурбулентным режимом. По оси абсорбера расположен вал с четырьмя перфорированными дисками. Скорость абсорбции N0+N02 непрерывно возрастает с увеличением окружной скорости дисков. Это дает возможность интенсифицировать процесс поглощения оксидов азота растворами и суспензиями щелочей.
Селективные абсорбенты
В зависимости от производственных условий, характеристики газовой смеси и поставленной задачи можно рекомендовать различные селективные поглотители. Так, для очистки газов (кислород отсутствует) с преимущественным содержанием оксида азота служат растворы сульфата и хлорида закиси железа, тиосульфата натрия Na2S203 и др. В первом и втором случаях имеют место реакции:
FeCI2 + NO = Fe(NO)CI2;
FeS04 + NO = Fe(N0)S04.
При нагреве до 95-100 °C комплекс Fe(N0)S04 распадается и NO выделяется в чистом виде, а восстановленный раствор вновь возвращается в производство.
Применение растворов восстановителей NaHS03, (NH2)2CO, Na2S203 приводит к дефиксации азота:
Na2S203 + 6NO = 3N2 + 2Na2S04 + 2S02;
2NaHS03 + 2NO = N2 + 2NaHS04;
2(NH2)2CO + 6NO = 5N2 + 4H20 + 2C02.
Реакции приемлемы для газов с малой степенью окисленности
N0.
Наиболее доступный и эффективный поглотитель (при отсутствии в газе кислорода) - раствор FeS04, отход металлообрабатывающих заводов. Поглотительная способность раствора зависит от количества за- кисного железа, температуры и парциальной упругости оксида азота над раствором. При сравнительно низких температурах - 15-20 °С - раствор может с достаточной полнотой удалять оксид азота даже малой концентрации. Предел растворимости оксида азота - соотношение NO:Fe++ =1:1. Присутствие в растворе серной и азотной кислот, солей или органических добавок снижает поглотительную способность. В случае очистки газов, не содержащих кислорода, раствор закисного железа можно подвергать многократной регенерации с последующим применением для абсорбции. При этом окисление мало заметно и абсорбционные свойства раствора сохраняются длительное время.
Серная кислота используется для удаления высокоокисленных оксидов азота. Этот способ наиболее эффективен при соотношении N0:N02 = 1:1. В этом случае получают нитрозилсерную кислоту:
N203 + 2H2S04 = 2HNSOs + Н20.
При подогреве этой кислоты или при разбавлении ее водой наблюдается обратный процесс с выделением оксидов азота в чистом виде:
2HNS05 + Н20 = 2H2S04 + NO + N02.
Взаимодействие жидких сорбентов с оксидами азота наиболее эффективно в температурном интервале 20-40 °С. Как правило, санитарная очистка с их помощью довольно затруднена. Поэтому при значительном содержании оксидов азота в случае производства концентрированной азотной кислоты используется двухступенчатая очистка: 1 стадия - щелочное поглощение с получением нитрит-нитратных солей; 2 стадия - ка
Дата добавления: 2016-12-27; просмотров: 4170;











