Шестичленные гетероциклы.
Среди шестичленных азотсодержащих гетероциклов рассмотрим пиридин, пиримидини их производные.
Пиридин- бесцветная жидкость, хорошо смешивается с водой и органическими растворителями, имеет неприятный характерный запах. Пиридин токсичен, поражает центральную нервную систему.
Порядок обозначения и степени окисления углеродных атомов в пиридине
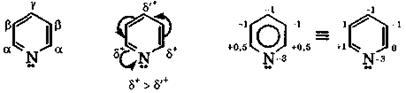
|
Пиридин является ароматическим соединением. Атомы углерода пиридинового кольца находятся в sp-гибридном состоянии, а атом азота - в состоянии sp2-II. В образовании циклической π-сопряженной системы участвуют шесть p-электронов (по одному от каждого атома цикла, включая гетероатом) (рис. 11).
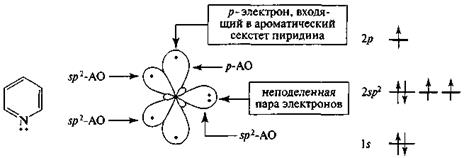
|
пиридин пиридиновый атом азота
Рис. 11. Распределение электронов пиридинового атома азота по орбиталям
Поскольку электроотрицательность атома азота по сравнению с углеродом больше, то азот стягивает к себе π-электронное облако, понижая электронную плотность ароматического кольца. Из-за этого пиридин является электронодефицитным соединениеми труднее, чем бензол, вступает в реакции электрофильного замещения. В пиридине электронная плотность неравномерно распределена по атомам углерода, что подтверждается расчетными и экспериментальными (спектральными) данными. Степени окисления его α-углеродных атомов выше, чем у других углеродных атомов кольца.
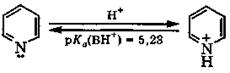
|
В отличие от пиррола, у пиридина неподеленная пара электронов атома азота не участвует в образовании ароматического секстета. Благодаря наличию свободной электронной пары у атома азота пиридин и его производные являются основаниями. С кислотами они образуют соли пиридиния.
пиридин пиридиний-катион
Основность пиридина (рКа(ВН+) = 5,23) несколько больше, чем у анилина (рКа(ВН+) = 4,60), но значительно меньше основности алифатических аминов (рКа(ВН+) ≈ 10).
Распределение электронной плотности в пиридине определяет ориентацию электрофильного замещения в β-положение, а нуклеофильного – в α- и γ-положения. Электрофильное замещение у производных пиридина протекает с большим трудом, так как оно обычно проводится в кислой среде, где пиридин существует в виде катиона. Положительный заряд на атоме азота еще больше понижает электронную плотность в ядре и затрудняет атаку ядра электрофильной частицей:
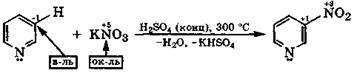
|
пиридин 3-нитропиридин
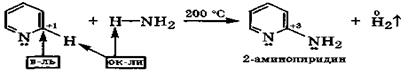
|
В реакции нуклеофильного замещения по α-углеродному атому пиридин вступает легче:
Рассмотренные реакции замещения являются одновременно реакциями межмолекулярного окисления-восстановления.
Каталитическое гидрирование пиридина водородом протекает постепенно и трудно, а приводит в итоге к пиперидину:
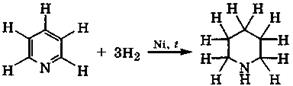
|
пиридин пиперидин
Реакция сопровождается восстановлением атомов углерода кольца, а также переходом всех его атомов, включая атом азота, в электронное состояние sp3. Поэтому основность азота возрастает: рКа(ВН+) = 11,0.
Атом азота в пиридине является нуклеофилом и способен алкилироваться с образованием четвертичных алкилпиридиниевых солей:

|
При этом электронодефицитность пиридиниевого ядра повышается из-за появления положительного заряда на атоме азота.
Производные пиридина. Многие природные соединения: витамины, коферменты, алкалоиды и большое число лекарственных препаратов - являются производными пиридина.
Никотин - бесцветное масло с табачным запахом, его содержание в листьях табака доходит до 8 %. Соединение очень ядовито, летальная доза для человека - 40 мг. Воздействует на вегетативную нервную систему и сужает кровеносные сосуды. Не исключено, что это является следствием изменения состояния воды внутри клеток соответствующих тканей из-за проникновения в них никотина - гидрофобного соединения.
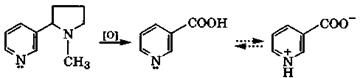
|
никотин никотиновая кислота
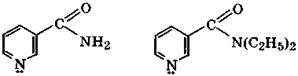
|
никотинамид кордиамин
Одним из продуктов окисления никотина в жестких условиях является никотиновая кислота (β-пиридинкарбоновая кислота), которая имеет амфотерные свойства: рКа(СООН) = 2,07, рКа(ВН+)= 4,73. Подобно α-аминокислотам она в кристаллическом состоянии и отчасти в растворах существует в виде таутомера с биполярно-ионной структурой. Никотиновая кислота - провитамин, поскольку ее амид — никотинамид — является витамином PP. Недостаток этого витамина вызывает заболевание кожи, называемое пеллагрой. Диэтиламид никотиновой кислоты - кордиаминиспользуется как эффективный стимулятор центральной нервной системы.
|
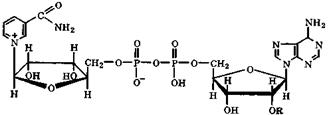
Никотинамиднуклеотиды. Важными представителями этой группы соединений являются коферменты никотин-амидадениндинуклеотид(НАД+) и его фосфат (НАДФ+):
НАД+ (R=H)
НАДФ+ (R= -РО(ОН)2)

|
В молекулах этих коферментов из-за наличия положительно заряженного атома азота и электроноакцепторной амидной группировки электронодефицитность пиридинового ядра возрастает настолько, что они способны проявлять окислительные свойства. Поэтому эти коферменты в комплексе с ферментами участвуют в окислительно-восстановительных реакциях в виде окисленных форм НАД+ и НАДФ+, содержащих никотинамидный остаток в виде пиридиниевого катиона, и восстановленных форм НАД(Н) и НАДФ(Н), где указанный фрагмент, приняв два электрона тон, превратился в 1,4-дигидропиридиновую группировку:
сопряженная окислительно-восстановительная пара
НАД+ 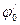 = - 0,320 В НАДФ+
= - 0,320 В НАДФ+ 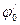 = - 0,324 В
= - 0,324 В
Все окислительно-восстановительные превращения биосубстратов под действием никотинамиднуклеотидов являются реакциями межмолекулярной дисмутации за счет углеродных атомов участников реакции. При переходе окисленной формы коферментов в восстановленную происходит накопление энергии, выделяемой при окислении субстрата. Накопленная восстановленной формой энергия затем расходуется в других эндэргонических процессах с участием этих коферментов.
Пиридоксальфосфат и витамин B6. В пиридоксальфосфате за счет электронодефицитности пиридинового кольца у углеродного атома альдегидной группы повышается склонность к окислительно-восстановительным превращениям. Поэтому это соединение является коферментом окислительно-восстановительных реакций трансаминирования α-кетокислот α-аминокислотами и в реакциях декарбоксилирования ряда аминокислот.
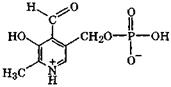
|
пиридоксальфосфат
|
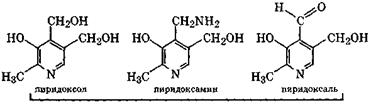
Витамин В6 (пиридоксин)
Сочетание трех индивидуальных веществ: пиридоксола, пиридоксамина и пиридоксаля– рассматривают как витамин В6(пиридоксин), так как в организме они все способны перейти в пиридоксальфосфат, участвующий в химических реакциях, связанных с деятельностью данного витамина. Отсутствие в пище витамина В6 сопровождается резким нарушением обмена белков и липидов, что ведет к развитию атеросклероза, различных дерматитов и нарушению кроветворения.
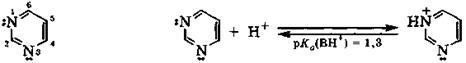
|
Пиримидин и его производные. Пиримидин содержит два атома азота в положениях 1 и 3 шестичленного цикла, имеющего ароматическую шестиэлектронную π-систему. В связи с тем, что оба атома азота находятся в sp2-IIсостоянии и их неподеленные электронные пары не участвуют в образовании ароматической системы, пиримидин проявляет свойства слабого основания (рКа(ВН+) = 1,3):
Основность пиримидина резко понижена по сравнению с пиридином (рКа(ВН+) = 5,2) из-за электроноакцепторных свойств второго атома азота, находящегося в ядре. Протонизация одного атома азота настолько понижает основность другого атома азота, что дальнейшее солеобразование в естественных условиях не происходит.
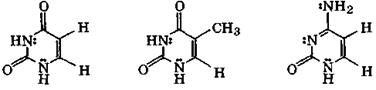
Большое значение в химии нуклеиновых кислот имеют следующие оксо- и аминопроизводные пиримидина: урацил, тимин и цитозин:
|
урацил тимин цитозин
Для этих соединений теоретически возможна прототропная лактим-лактамная таутомерия. Соответствующие таутомеры различаются не только положением протона (у атома кислорода или у атома азота), но и электронным состоянием атома азота (sp2-IIили sp2-I):

|
лактимный лактамный
таутомер таутомер
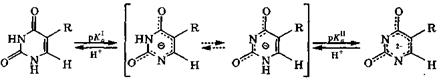
У таутомеров имеется общий амбидентный анион, отрицательный заряд которого делокализован между атомами, участвующими в таутомерии. Последнее обстоятельство объясняет двойственную реакционную способность рассмотренных соединений, т. е. способность образовывать и О- и N-производные. Исследования кислотно-основных свойств и спектральных характеристик указанных оксопиримидинов и родственных им соединений свидетельствуют, что и в кристаллах, и в растворах для них характерна только лактамная форма, аих ионы амбидентны.
|
Урацил и тиминв естественных условиях являются слабыми двухосновными кислотами, причем их моноанионы существуют в виде двух таутомеров, различающихся положением оставшегося протона у атомов азота N-1 или N-3 и распределением делокализованного отрицательного заряда:
смесь таутомеров моноаниона дианион
рК 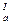 рК
рК 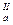
урацил (R=H) 9,4 13,9
тимин (R=СН3) 9,9 13,9
Таким образом, в биологических средах с рН<7,5 урацил и тимин существуют в молекулярной форме.
Цитозин - амфолит: он протонируется по атому N-1, имеющему свободную от участия в сопряжении электронную пару, а за счет депротонирования атома N-3 проявляет слабые кислотные свойства:
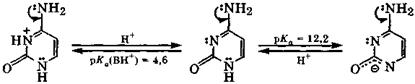
|
катион молекула анион
цитозина цитозина цитозина
В биологических средах с рН = 3÷6 цитозин существует в виде смеси катионов и молекул, а при рН ≈ 7 - в молекулярной форме.
Среди природных оксипиримидинов важную роль играют оротоваяи барбитуровая кислоты. Оротовая кислота (урацил-6-карбоновая кислота) является метаболитом,
участвующим в превращении аспарагиновой кислоты в пиримидиновые производные. В условиях организма это довольно сильная двухосновная кислота:
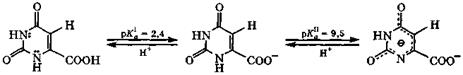
|
оротоновая кислота
Оротат калия - стимулятор обменных процессов в организме.
Для барбитуровой кислоты характерна кето-енольная таутомерия с преобладанием кетотаутомера ( ≈ 98 %). Барбитуровая кислота - достаточно сильная СН-кислота. Лактимная форма для этой кислоты не обнаружена.
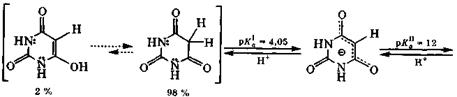
|
барбитуровая кислота
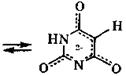
|
|
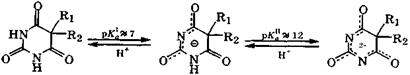
В медицине в качестве снотворных и противосудорожных средств применяют 5,5-дизамещенные барбитуровые кислоты: барбитал и фенобарбитал, называемые барбитуратами. Они существуют только в лактамной форме и являются слабыми NH-кислотами:
барбитал (веронал) R1=R2=С2Н5
фенобарбитал (люминал) R1= С2Н5; R2= С6Н5
Дата добавления: 2019-09-30; просмотров: 943;











