Шестичленные гетероциклы с одним гетероатомом. Пиридин
Пиридиновый гетероцикл содержит делокализованнный секстет π-электронов. Энергия делокализации молекулы пиридина очень близка к таковой бензола и составляет 134,4 кДж/моль. Пиридин, как и бензол, представляет собой плоскую систему, но здесь длины связей отличаются от бензола: С-С = 0,140 нм, а С-N = 0,134 нм. Из этого следует, что в молекуле пиридина валентные углы искажены по сравнению с бензолом и, следовательно, пиридиновый цикл не является правильным шестиугольником.
Выше было показано, что гетероатом азота, будучи более электроотрицательным по сравнению с атомами углерода кольца, способствует в целом понижению электронной плотности в цикле, в связи с чем пиридин относится к π-дефицитным системам. В разделе 24.2. представлено строение пиридина. Здесь же приводится диаграмма, на которой показано распределение зарядов между атомами в цикле пиридина:

Из диаграммы распределения электронной плотности в пиридине следует, что на атомах углерода С-2, С-4 и С-6 имеет место частичный положительный заряд и, следовательно, они – электронодефицитны. В положениях С-3 и С-5 наблюдается слегка повышенная электронная плотность. Наибольший отрицательный заряд, как это видно, сосредоточен на гетероатоме азота, что свидетельствует о его высокой нуклеофильности. Распределение зарядов в пиридиновом цикле хорошо согласуется с его резонансными структурами:
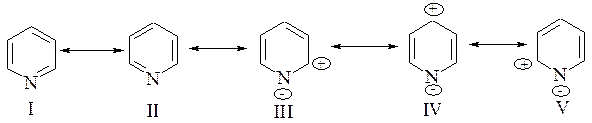
Значительный отрицательный заряд на атоме азота свидетельствует также об основных свойствах пиридина, что сравнимо с анилином.
В то же время пиридин, в отличие от бензола, может вступать в реакции как с электрофильными, так и нуклеофильными реагентами, что вполне согласуется с характером распределения электронной плотности.
Основные свойства. Неподеленная пара электронов гетероатома азота находится на sp2-гибридной орбитали, которая расположена вне плоскости цикла, поэтому она доступна для электрофильного присоединения. Нуклеофильность этой электронной пары выражена в большей степени, чем у азота в аминах: пиридиновый азот (Nsp2) более электроотрицателен, чем Nsp3 в аминах.
Водные растворы пиридина имеют щелочную реакцию. С сильными кислотами пиридин образует кристаллические соли:
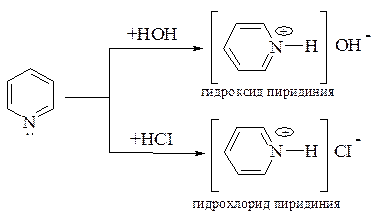
Электрофильное присоединение. Электрофильные реагенты присоединяются к гетероатому азота, образуя четвертичные соли: с алкилгалогенидами образуются соли N-алкилпиридиния, с ацилирующими реагентами – соли N-ацилпиридиния. По гетероатому азота можно получить и другие соединения:
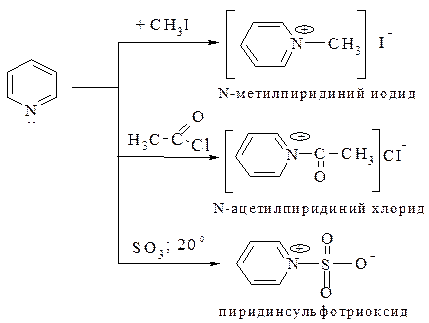
Электрофильное замещение. Этот тип реакций с участием пиридина протекает с большим трудом. Объясняется это тем, что электрофильная атака предпочтительнее может проходить по атому азота (см. выше), чем по углеродному атому. Поэтому по ходу таких реакций, как нитрование, сульфирование, галогенирование в SE реакцию вовлекается не свободное основание пиридина, а интермедиат, в котором гетероатом азота либо протонирован (катион пиридиния), либо координирован с другими атомами или группой атомов. Возникающий при этом положительный заряд на гетероатоме азота значительно понижает общую электронную плотность в ядре и затрудняет SE реакцию.
Нитрование пиридина проходит в очень жестких условиях. Для этого используют нитраты натрия или калия в дымящей серной кислоте при 300°С, либо N2O4 в газовой фазе. Выход 3-нитропиридина очень низкий.
Сульфирование пиридина более эффективно проходит под действием олеума в присутствии сульфата ртути (II) при температуре 220-2700С.
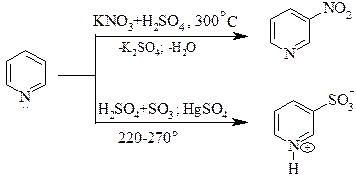
Галогенирование пиридинов проводят в разных условиях. Так, хлорирование молекулярным хлором проходит в газовой фазе в присутствии большого избытка хлорида алюминия:
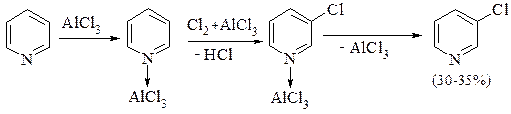
Бромирование пиридина проходит легко бромом в олеуме. Выход 3-бромпиридина составляет 90%.
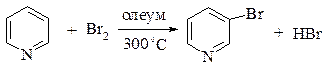
Нуклеофильное замещение. В реакциях нуклеофильного замещения пиридин и его производные проявляют повышенную реакционную способность.
Аминирование можно осуществлять амидом натрия при 130°С, в результате чего образуется 2-аминопиридин (реакция А.Е. Чичибабина, 1914 г.). Реакция протекает по типу SN2, т.е. по механизму присоединения-отщепления.

Щелочи реагируют с пиридином при температуре ≈ 400°С с образованием соответствующей соли α-гидроксипиридина:
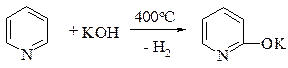
В реакциях аминирования и гидроксилирования возможно также образование 4-замещенных производных.
Гидрирование (восстановление) пиридина приводит к образованию предельного циклического вторичного амина – пиперидина:

Реакции окисления. Ядро пиридина устойчиво к действию окислителей, но с пероксокислотами и пероксидом водорода окисление происходит по гетероатому азота с образованием N-оксида пиридина:

Гомологи пиридина окисляются легко до соответствующих пиридинкарбоновых кислот, что показано ниже на примере метилпиридинов (α-, β- и γ-пиколинов):

Атомы водорода в α-метилпиридине очень подвижны, что сравнимо с метилкетонами. В присутствии оснований в качестве катализаторов α-метилпиридин вступает в реакцию конденсации с образованием замещенных винилпиридинов:
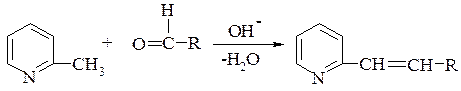
Пиридин – бесцветная жидкость, с неприятным характерным (пиридиновым) запахом. Т.кип. 115,60. Растворим в воде. Ядовит!
Дата добавления: 2020-10-01; просмотров: 612;











