Шестичленные гетероциклы с одним гетероатомом
Применение и значение пятичленных гетероциклических соединений
Пиррол – входит в состав гемоглобина, хлорофилла.
Пирролидин – входит в состав аминокислот (пролин, оксипролин).
Фуран – ТГФ.
Фурфурол  фуриловый спирт
фуриловый спирт  тетрагидрофуриловый спирт.
тетрагидрофуриловый спирт.
Фурфурол – селективный растворитель, в нефти, производство пластмасс (фенолальдегидных), получение фумаровой кислоты, лекарственных препаратов.
Тиофен – производные используются как лечебные препараты.
Имидазол – входит в состав аминокислот, белков, получение ускорителей вулканизации.
Тиазол – входит в состав пенициллина, используется для получения лекарственных препаратов.
Пиразол – получение лекарственных препаратов (антипирин, амидопирин), красящих веществ, фотореактивов.
Индол – входит в состав гетероауксина, аминокислот, белков. Используется для получения индиго, пурина.
Бензтиазол – получение ускорителей вулканизации (каптакс, альтакс).
Кумарон – инденкумароновые смолы.
Шестичленные гетероциклы с одним гетероатомом
Рассмотрим на примере группы пиридина.
Простейший член ряда – пиридин.
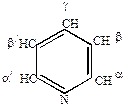
Бесцветная жидкость с неприятным запахом, Ткип=1150С. Смешивается с водой и с органическими растворителями, имеет большое применение в качестве растворителя и катализатора при химических реакциях.
Монометилпиридины – пиколины.
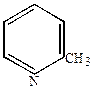
| 
| 
|
 -пиколин -пиколин
|  -пиколин -пиколин
|  -пиколин -пиколин
|
Диметилпиридины – лужидины
Триметилпиридины – коллидины
(положение радикалов указывается цифрами – нумерация от атома азота к ближайшим заместителям).
Получение
1) Выделение из аммиачной воды, образующейся при сухой перегонке каменноугольной смолы.
2) Конденсация ацетилена и HCN.
| раскаленные
трубки

| 
|
3) Синтез Ганца-Чичибабина – конденсация карбонильных соединений с аммиаком (наиболее распространенный промышленный метод синтеза соединений ряда пиридина).
 
| 
| (1) | ||
| 4-метил-3-этилпиридин | ||||

|
+ NH3  -4H2O
-4H2O
| |||
| ацетальдегид | 
| 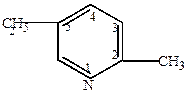
| (2) | |
| 2-метил-5-этилпиридин |
2-метил-5-этилпиридин нашел применение для получения мономера винилпиридиновых латексов.
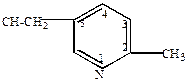
| (Cr2O3 +
другие окислители)
T0
 -H2
-H2
| 
|
| 2-метил-5-винилпиридин |
| n |

|
полимеризация

| 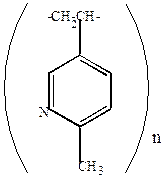
|
| поли-2-метил-5-винилпиридин |
Химические свойствапиридина сходны со свойствами бензола. Проявляет ароматические свойства (более ярко выраженные, чем у пятичленных гетероциклов), однако распределение электронной плотности в пиридине не вполне равномерное, он проявляет ненасыщенность в большей степени, чем бензол (но меньше, чем тиофен). Это вытекает из электронного строения пиридина. В кольце пиридина 3 двойные связи, 6 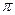 -электронов, образующих ароматический секстет. Поэтому неподеленная пара электронов азота мало участвует в сопряжении с
-электронов, образующих ароматический секстет. Поэтому неподеленная пара электронов азота мало участвует в сопряжении с 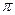 -электронами кольца. Поскольку азот обладает более высокой электроотрицательностью, чем углерод, электронное облако кольца оттянуто к азоту, и пиридин имеет дипольный момент, направленный к азоту.
-электронами кольца. Поскольку азот обладает более высокой электроотрицательностью, чем углерод, электронное облако кольца оттянуто к азоту, и пиридин имеет дипольный момент, направленный к азоту.
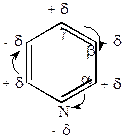
 =2,2Д
=2,2Д
Самая высокая электронная плотность у азота. Электронная плотность в  -положении выше, чем в
-положении выше, чем в 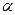 и
и  .
.
Химические реакции пиридина можно подразделить на следующие типы:
1) реакции аминного азота;
2) реакции электрофильного замещения в ядре;
3) реакции нуклеофильного замещения в ядре;
4) реакции окисления и восстановления.
1) реакции аминного типа
а) пиридин проявляет основные свойства благодаря наличию трехвалентного атома азота, имеющего неподеленную пару электронов. Однако, пиридин – основание менее сильное, чем пиперидин, но более сильное, чем анилин.
| 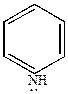
| 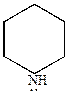
|
| Кд=4,0.10-10 | Кд=1,7.10-9 | Кд=1,33.10-3 |
р- 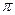 -сопряжение
-сопряжение
Основность пиридина
Меньшая основность пиридина по сравнению с (СН3)N объясняется различием в гибридизации: в (СН3)N азот находится в состоянии sp3-гибридизации, а в пиридине – в sp2-гибридизации (Веселовская, 1982г).
Доля s-электронов на орбите, занятой неподеленной парой электронов, больше при sp2-гибридизации, чем при sp3-гибридизации, а s-электронное облако менее вытянуто и прочнее удерживается ядром (при sp3-гибридизации неподеленная пара состоит из 1 s-электрона и 1 sp3-гибридного электрона, при sp2-гибридизации – из 1 s-электрона и 1 sp2-гибридного электрона, один р-электрон расположен перпендикулярно плоскости кольца и участвует в образовании ароматического секстета).
Например,
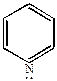
|
+ HCl 
| 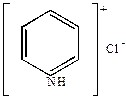
|
| хлористый пиридиний |
б) пиридин образует комплексные соли с галоидными алкилами.
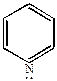
|
+ C2H5I 
| 
|
| йодистый этил | N-этилпиридинийиодид |
Эти соли непрочны, при нагревании изомеризуются с переходом радикала в положение 2 или 4 (  или
или  ).
).

| T0
 
| 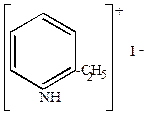
|
 -этилпиридинийиодид -этилпиридинийиодид
| ||
| 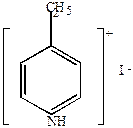
| |
 -этилпиридинийиодид -этилпиридинийиодид
|
2) Реакции электрофильного замещения
Пиридин труднее вступает в эти реакции, чем бензол. В большинстве случаев это вызывается промежуточным образованием катиона пиридиния, где атом азота несет положительный заряд и влияет на кольцо как заместитель второго рода.
Механизм электрофильного замещения.

|
+X+ 
| 
| +X+

| 
|
| 
|
При присоединении в  -положение резонансная стабилизация
-положение резонансная стабилизация 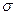 -комплекса не приводит к возникновению у азота 2-го положительного заряда.
-комплекса не приводит к возникновению у азота 2-го положительного заряда.
Если бы присоединение происходило в 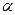 -положение
-положение

|
+X+ 
| 
| +X+

| 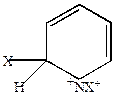
|
мало вероятно
Нитрование, сульфирование и др. идут при высоких температурах и в основном в положение  .
.
а) сульфирование

|
+ HOSO2OH 
| 
| HOSO2OH
дым.
 (HgSO4)
кат.
(HgSO4)
кат.
|
| катион пиридиния (кислый сернокислый пиридиний) | |||
 -H2O
-H2O
| 
| ||
кислый сернокислый  -пиридиний -пиридиний
|
б) нитрование

|
+HONO2 
| 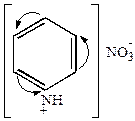
| HONO2
конц.
 3000
3000
| 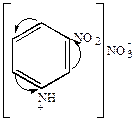
|
| азотнокислый пиридиний | азотнокислый
 -нитропиридиний -нитропиридиний
|
При более высокой температуре образуются и другие изомеры.
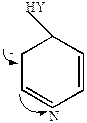
3) Реакции нуклеофильного замещения
Благодаря электронооттягивающему действию азота ядро пиридина обедняется электронами, и атака нуклеофильных реагентов протекает легче, чем у бензола.
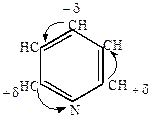
|
  + KOH + KOH
| 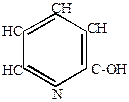
|
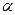 -оксипиридин -оксипиридин
| ||

| 
| |
 -оксипиридин -оксипиридин
|
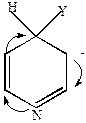
Механизм нуклеофильного замещения

|
+Y- 
| 
|
| 
|
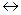
| 
|
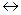
| 
|

|
+Y- 
| 
|
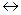
| 
|
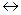
| 
|
Граничные структуры (мезомерные формы аниона). Атака нуклеофильного реагента происходит в 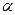 или
или  -положение, в которых легче образуется
-положение, в которых легче образуется 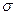 -комплекс, т.к. его стабилизация не связана с образованием мезомерных форм, имеющих отрицательные заряды рядом с азотом.
-комплекс, т.к. его стабилизация не связана с образованием мезомерных форм, имеющих отрицательные заряды рядом с азотом.
4) Реакции окисления и восстановления
а) Окисление пиридина происходит трудно. При определенных условиях реакция может идти с образованием N-окиси.

| + |
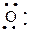  (H2O2 + CH3COOH)
(H2O2 + CH3COOH)
| 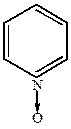
|
Двойные связи при этом не затрагиваются. N-окись отличается от пиридина большей легкостью протекания реакций электрофильного замещения.

| 1000
+KNO3  (H2SO4 дым.)
(H2SO4 дым.)
| 
| +H2O + KHSO4 |
| N-окись паранитропиридина | кислый сернокислый калий |
При этом реакция идет в  -положение вследствие сопряжения ненасыщенных пар электронов с
-положение вследствие сопряжения ненасыщенных пар электронов с 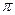 -электронами кольца.
-электронами кольца.
б) окисление гомологов пиридина протекает довольно легко за счет окисления боковой цепочки с образованием пиридинкарбоновых кислот.
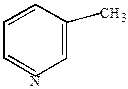
|
+ 3 O  (KMnO4) –H2O
(KMnO4) –H2O
| 
|
 -пиколин -пиколин
|  -пиридинкарбоновая кислота (никотиновая) -пиридинкарбоновая кислота (никотиновая)
|
в) восстановление пиридина протекает легче, чем у бензола.

|
+ 6 H  (Na+C2H5OH)
(Na+C2H5OH)
| 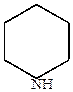
|
| пиперидин |
При более энергичном гидрировании молекулярным водородом в присутствии катализаторов Pt, Pd и температуре 1800С происходит раскрытие цикла.

| Pt, Pd
+ 4 H2  C5H11NH2
1800 C5H11NH2
1800
|
| амиламин |
Восстановление иодистым водородом приводит к отщеплению аммиака.

| 2800
+ 11 HI  C5H12 + NH4I + 5 I2 C5H12 + NH4I + 5 I2
|
| пентан йодистый аммоний |
Дата добавления: 2020-10-14; просмотров: 477;











