Пятичленные гетероциклы.
Пятичленные гетероциклические соединения можно рассматривать как продукт замещения в бензольном цикле одной группировки —СН=СН— на гетероатом с неподеленной парой электронов. Внимание будет уделено пирролу, индолу и имидазолу, поскольку эти азотсодержащие соединения или их производные составляют основу многих природных биологически активных веществ и лекарственных средств.
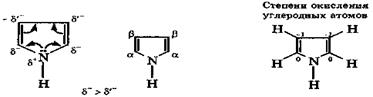
Пиррол. Молекула пиррола содержит систему сопряженных связей, включая неподеленную пару электронов атома азота:
|
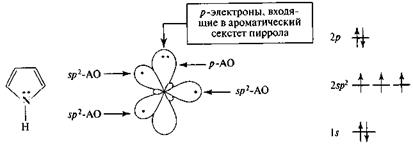
Четыре атома углерода молекулы пиррола находятся в sp2-coстоянии, а атом азота — в sp2-I состоянии, соответственно все σ-связи между ними расположены в одной плоскости. Неподеленная электронная пара атома азота находится на р-орбитали и участвует в сопряжении с π-электронами соседних двойных связей (рис. 10).
|
пиррол пиррольный атом азота
Рис. 10. Распределение электронов пиррольного атома азота по орбиталям
Энергия делокализации электронов в π-системе пиррола составляет 110 кДж/моль, следовательно, он имеет ароматический характер. Атом азота является донором электронной пары для π-системы, поэтому на углеродных атомах цикла плотность π-электронов увеличена, причем в α-положении больше, чем в β-положении. Это делает пиррол электроноизбыточным гетероциклом (суперароматическая структура), который вступает в реакции электрофильного замещения по сравнению с бензолом и легко окисляется.
|
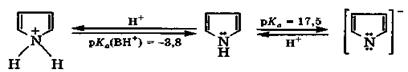
Пиррол - бесцветная жидкость (т. кип. 131 °С) с запахом хлороформа, практически нерастворимая в воде и быстро темнеющая на воздухе из-за окисления. Молекула пиррола содержит полярную связь N—Н и является очень слабой NH-кислотой (рКа = 17,5). При взаимодействии со щелочными металлами пиррол образует соли, устойчивые в отсутствие воды:
пирролий-катион пиррол пиррил-анион
неустойчив, легко полимеризуется
Поскольку неподеленная электронная пара атома азота делокализована, то пиррол является очень слабым основанием.
В сильнокислой среде ароматическая система пиррола нарушается вследствие протонирования, и он легко полимеризуется с образованием темной смолы. Поэтому пиррол называют ацидофобным, т. е. не выдерживающим присутствия кислот.
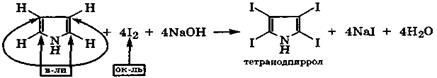
|
Реакции электрофильного замещения в пирроле обычно проводят в щелочной среде. Даже такой слабый электрофил, как I2, в этих условиях замещает четыре водородных атома пиррола, образуя тетраиодпиррол:
Реакция сопровождается окислением углеродных атомов пиррола и восстановлением атомов иода.
Наиболее реакционноспособно к электрофильному замещению в пирроле α-положение. Так, конденсацией пиррола с муравьиной кислотой можно получить порфин:
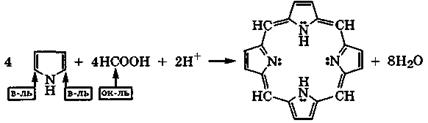
|
порфин
Эта конденсация, естественно, тоже сопровождается окислением α-углеродных атомов пиррола и восстановлением углеродных атомов муравьиной кислоты.
Плоский макроцикл порфина является ароматической сопряженной системой, π-электронное облако которой содержит 26 электронов (22 электрона одиннадцати двойных связей и две неподеленные электронные пары двух атомов азота). Это соответствует правилу ароматичности 4n+2, где п = 6. Порфины, частично или полностью замещенные в пиррольных циклах, называются порфиринами. Это активные хелатообразующие четы-рехдентатные лиганды, входящие в состав важных природных комплексных соединений: гемоглобина, цитохромов, хлорофилла.
При биологическом окислении в печени гемоглобина и других порфиринсодержащих метаболитов образуются билирубиноиды, содержащие линейную тетрапиррольную систему. Наиболее важный из них - билирубинимеет оранжевую окраску.
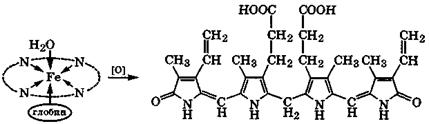
|
гемоглобин билирубин
Эти вещества являются пигментами желчи, часть которых выделяется с мочой, сообщая ей характерный желтый оттенок. Они же вызывают пожелтение кожи при желтухе, что свидетельствует о чрезмерном разрушении порфинсодержащих метаболитов в печени.
|
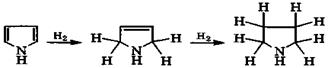
При гидрировании пиррола происходит постепенное присоединение водорода по кратным связям:
пиррол пирролин пирролидин
|
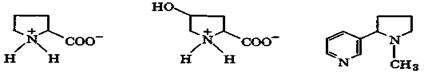
При этом ароматическая система пиррола разрушается и атом азота переходит в sр3-состояние. В результате основность полученных соединений намного выше, чем основность пиррола (рKа(ВН+) = -3,8). Так, для пирролидина рКа(ВН+) = 11,3. Пирролидиновое кольцо входит в состав α-аминокислот (пролин, гидроксипролин), а также алкалоидов (никотин):
пролин 4-гидроксипролин никотин
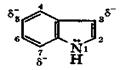
Индол (бензопиррол) является конденсированным гетероциклическим соединением, состоящим из бензольного и пиррольного ядра. Индол имеет циклическую сопряженную систему, содержащую 10 электронов. В индоле электронодонорное действие атома азота проявляется в повышении электронной плотности на углеродных атомах, особенно в положениях 3, 5 и 7. В отличие от пиррола, в индоле электрофильные реагенты прежде всего атакуют углеродный атом в положении 3, что обусловлено влиянием бензольного цикла. Индол, подобно пирролу, практически не обладает основными свойствами, ацидофобен, ведет себя как слабая NH-кислота (рКа = 17), легко окисляется, из-за чего быстро темнеет на воздухе.
|
|
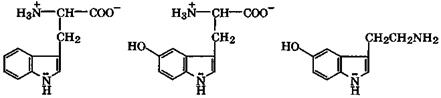
триптофан 5-гидрокситриптофан серотонин
|
Среди биологически активных производных индола прежде всего следует отметить α-аминокислоту — триптофан.В организме триптофан гидроксилируется в 5-гидрокситриптофан, который в результате декарбоксилирования превращается все-ротонин.Серотонин играет исключительно важную роль в обмене веществ у высших млекопитающих, регулируя передачу импульсов в нервных тканях и кровяное давление.
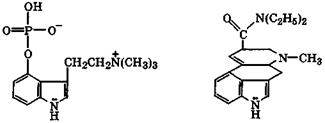
псилоцибин диэтиламид лизергиновой кислоты (ЛСД)
Производными индола являются наиболее сильные галлюциногены: псилоцибини диэтиламид лизергиновой кислоты (ЛСД). Последний — наиболее сильнодействующий наркотик, его действующая доза около 10-3 мг. Эти галлюциногены — антагонисты серотонина, поэтому их применение нарушает концентрацию серотонина в мозге, что приводит к отклонению от нормального психического состояния.

|
Имидазол.Это достаточно высокоплавкое и высококипящее вещество (т. пл. 90 "С, т. кип. 256 °С) представляет собой пятичленный гетероцикл с двумя атомами азота, находящимися в 1-м и 3-м положениях кольца. Один из этих атомов аналогичен атому азота в пирроле и ответствен за слабокислотные свойства имидазола, другой похож на пиридиновый атом азота и обусловлавливает слабоосновные свойства имидазола. Таким образом, имидазол является амфотерным соединением; он способен образовывать соли с сильными кислотами и щелочными металлами.
имидазол
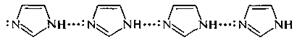
|
Наличие в молекуле имидазола NH-кислотной группировки и основного атома азота —N= служит причиной образования молекулярных ассоциатов за счет водородных связей.
Следствием такой ассоциации является быстрый межмолекулярный водородный обмен, который приводит к прототропной таутомерии – таутомерии азолов – у некоторых гетероциклов, в частности имидазола, пиразола и их производных.
Прототропная таутомерия между димерами имидазола приводит к тому, что его производные, имеющие одинаковые заместители в разных положениях 4 и 5, неразличимы, поскольку они являются быстровзаимопревращающимися (менее 0,1 с) таутомерами, т. е. фактически одним и тем же веществом.
Имидазол и его производные, являясь, подобно молекуле воды, одновременно и донорами и акцепторами протонов, обладают исключительной способностью катализировать электрофильно-нуклеофильные реакции. Это обусловлено их способностью одновременно и согласованно воздействовать на электрофильные и нуклеофильные центры взаимодействующих соединений. Такое свойство имидазола играет важную роль в механизме действия гидролитических ферментов, способствующих гидролизу сложных эфиров, амидов и пептидов.
Высокая поляризуемость имидазола и его производных и повышенная нуклеофильность атома N-3 делают эти соединения активными лигандами по отношению к катионам d-металлов. Поэтому во многих металлопротеидах связь белка с катионом металла осуществляется через атом N-3 имидазольного заместителя α-аминокислоты гистидина.
Гистидин является одной из природных незаменимых α-аминокислот, содержащей имидазольный заместитель. Белки, содержащие гистидин, благодаря имидазольному заместителю способны: поддерживать нейтральную среду рН ≈ 7 биологических систем, выступать катализаторами электрофильно-нуклеофильных реакций и образовывать достаточно прочные комплексы-металлопротеиды. При декарбоксилировании гистидина образуется гис-тамин, играющий важную роль в стимуляции сокращения мускулатуры кишечника, спастических сокращений бронхов, также в развитии аллергических и иммунных реакций:
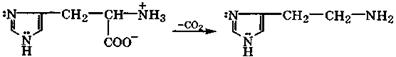
|
гистидин гистамин
Пиразол – является изомером имидазола. Атомы азота в цикле пиразола расположены рядом. В химическом поведении этих двух изомерных пятичленных гетероциклов имеется много общего. Подобно имидазолу пиразол амфотерен и склонен к образованию ассоциатов. Для монозамещенных производных пиразола также характерна прототропная таутомерия.
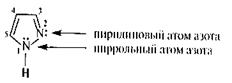
пиразол
Производные пиразола в природе не обнаружены. Наиболее известным производным пиразола является пиразолон-5, для которого практически обнаружены четыре изомерные формы — две гидрокси- и две оксо-формы, между которыми имеет место таутомерное равновесие.
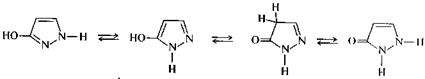
гидроксиформы оксоформы
Пиразолон-5
На основе пиразолона-5 созданы известные лекарственные средства — антипирин, амидопирин, анальгин. Они являются производными оксоформы, которая показана последней.
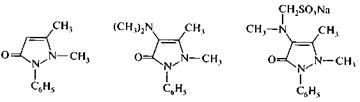
антипирин амидопирин анальгин
2,3 – диметил -1-фенил- 2,3 – диметил -1- фенил-
– пиразолон -5 4 – диметиламинопиразолон - 5
Антипирин является одним из первых синтетических жаропонижающих, болеутоляющих и успокаивающих средств. До недавнего времени использовался и амидопирин. Анальгин, по активности и быстроте действия превосходящий амидопирин и антипирин, является сульфопроизводным амидопирина.
Дата добавления: 2019-09-30; просмотров: 1243;











