Строение и свойства аминокислот.
(Самостоятельная работа студентов)
Аминокислоты — соединения, в молекулах которых одновременно присутствуют амино- и карбоксильные группы.
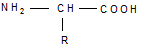
Природные α-аминокислоты являются биологически активными соединениями; их классификация приведена в табл. 19.
Строение аминокислот.Все α-аминокислоты* можно рассматривать как результат замены атома водорода в простейшей а-аминокислоте — глицине — на тот или иной радикал R. Таким образом, в соответствии с природой радикала R, называемого боковой цепью, -аминокислоты подразделяют на 4 группы, отличающиеся гидрофильностью или гидрофобностью боковых цепей, а также способностью боковой цепи проявлять кислотные или основные свойства (см. табл. 19).
Аминокислоты рассматриваются как производные карбоновых кислот, в которых положение аминогруппы относительно карбоксильной принято указывать буквами α, β, γ и т. д., что равносильно цифрам 2, 3, 4 и т. д. соответственно. Хотя в природных объектах и обнаружено около 300 разных аминокислот, но в состав большинства пептидов и белков входят 20 наиболее часто встречающихся и поэтому важных аминокислот, причем все они α-аминокислоты.
Таким образом, в α-аминокислотах карбоксильная и аминогруппы связаны с одним и тем же углеродным атомом (Сα), у которого кроме того имеется заместитель R.
R— неполярный углеводородный заместитель, проявляющий гидрофобные (липофильные) свойства.Это восемь α-аминокислот: аланин, валин, лейцин, изолейцин, пролин, фе-нилаланин, триптофан и метионин, труднорастворимые в воде.
R— неионизующийся полярный заместитель, проявляющий гидрофильные свойства.Это пять α-аминокислот, которые лучше растворяются в воде: глицин, серии, треонин, аспарагин и глутамин.
R— полярный заместитель, проявляющий гидрофильные и кислотные свойства.Это четыре α-аминокислоты: аспарагиновая и глутаминовые кислоты, цистеин и тирозин.
В аспарагиновой и глутаминовой кислотах заместитель полностью отдает протон своей карбоксильной группы в растворах с рН = 7 и поэтому, в этих условиях несет отрицательный заряд.
Таблица Важнейшие α-аминокислоты  и их
и их
кислотно-основные характеристики
| Название | Формула | Сокращение | 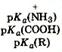
| pI | |
| русское | между-народное | ||||
| α-Аминокислоты с неполярным (гидрофобным) заместителем R | |||||
| Аланин | 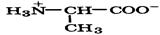
| Ала | Ala | 2,3 9,7 | 6,0 |
| Валин (незаменимая) | 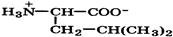
| Вал | Val | 2,3 9,6 | 6,0 |
| Лейцин (незаменимая) | 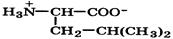
| Лей | Leu | 2,4 9,6 | 6,0 |
| Изолейцин (незаменимая | 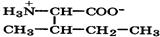
| Иле | Ile | 2,4 9,7 | 6,1 |
| Пролин | 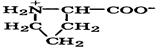
| Про | Pro | 2,0 10,6 | 6,3 |
| Фенилаланин (незаменимая) | 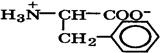
| Фен | Phe | 1,8 9,1 | 5,5 |
| Триптофан (незаменимая) | 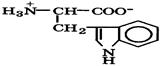
| Три | Trp | 2,4 9,4 | 5,9 |
| Метионин (незаменимая) | 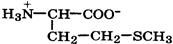
| Мет | Met | 2,3 9,2 | 5,8 |
| α-Аминокислоты с полярным (гидрофильным) заместителем R | |||||
| Глицин | 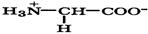
| Глу | Gly | 2,3 9,6 | 6,0 |
| Серин | 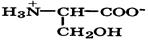
| Сер | Ser | 2,2 9,3 | 5,7 |
| Трионин (незаменимая) | 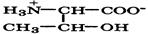
| Тре | Thn | 2,6 10,4 | 6,5 |
| Аспарагин | 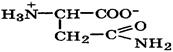
| Асн | Asn | 2,0 9,8 | 5,4 |
| Глутамин | 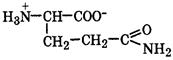
| Глн | Gln | 2,2 9,1 | 5,7 |
| α-Аминокислоты - кислотные | |||||
| Аспарагиновая кислота | 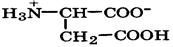
| Асп | Asp | 2,1 9,8 3,9 (COOH) | 3,0 |
| Глутаминовая кислота | 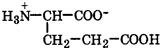
| Глу | Glu | 2,2 9,7 4,3 (COOH) | 3,2 |
| Цистеин | 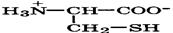
| Цис | Cys | 1,7 10,8 8,3 (SH) | 5,0 |
| Тирозин | 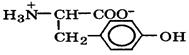
| тир | Tyr | 2,2 9,1 10,1 (OH) | 5,7 |
| α-Аминокислоты - основные | |||||
| Лизин (незаменимая) | 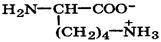
| Лиз | Lys | 2,2 9,0 + 10,5 (NH3) | 9,8 |
| Аргинин | 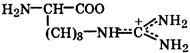
| Арг | Arg | 2,2 9,0 12,5 гуанидин | 10,8 |
| Гистидин | 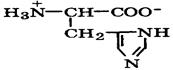
| Гис | His | 1,8 9,2 6,0 имидазол | 7,6 |
Стереохимия природных α-аминокислот характеризуется тем, что все они кроме глицина имеют асимметрический атом углерода (атом, связанный и с амино-, и с карбоксильной группой), конфигурация которого может быть отождествлена с конфигурацией L-глицеринового альдегида путем цепи химических превращений:
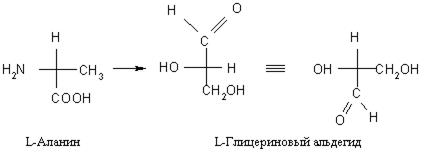
* За исключением нейтральной гидрофобной аминокислоты пролина (L-пирролидин-α-карбоновой кислоты).
При этом превращения либо не должны затрагивать хиральный центр, либо реакции должны протекать строго стереоспецифично. Следовательно, все природные α-аминокислоты являются L-энантиомерами.
Конфигурация асимметрического центра аминокислот определяет биологические свойства как самих аминокислот, так и олиго- и полимерных соединений, мономерами которых служат остатки аминокислот (эти соединения называют пептидами)
Свойства аминокислот.Аминокислоты представляют собой бесцветные кристаллические вещества с довольно высокими температурами плавления (более 230 °С). Большинство кислот хорошо растворимы в воде и практически не растворимы в спирте и диэтиловом эфире, что указывает на солеобразный характер этих веществ. Специфическая растворимость аминокислот обусловлена наличием в молекуле одновременно аминогруппы (имеющей основный характер) и карбоксильной группы (характеризующейся кислотными свойствами), благодаря чему аминокислоты принадлежат к амфотерным электролитам (амфолитам). В водных растворах и твердом состоянии аминокислоты существуют только в виде внутренних солей — цвиттер-ионов.
Кислотно-основное равновесие для аминокислоты может быть описано следующим образом:
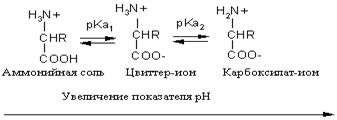
Если к раствору аминокислоты приложено электрическое поле, то в зависимости от показателя рН раствора ионы аминокислоты будут перемещаться по-разному: в кислой среде при рН < 7 аммонийные ионы аминокислот перемещаются к отрицательному полюсу (катоду), а в щелочной среде при рН > 7 карбоксилат-ионы — к положительному полюсу (аноду). Значение рН, при котором молекула аминокислоты электронейтральна, называют изоэлектрической точкой и обозначают рI. При значении рН, равном показателю рI, молекула аминокислоты в электрическом поле не перемещается. Изоэлектрическую точку определяют по соотношению
pI=0.5(pKa1+pKa2)
Реакции с участием только аминогруппы.Наличие в молекуле одновременно амино- и карбоксильной группы отражается и на поведении аминокислот в тех реакциях, в которых участвует только одна из двух функциональных групп. Аминогруппа, которая в аминах проявляет себя как нуклеофил, в биполярном ионе полностью лишена нуклеофильности из-за протонирования, поэтому ни реакция алкилирования по Гофману, ни ацилирование, свойственные аминам, не имеют места в случае аминокислот. Эти реакции могут происходить только при условии предварительного депротонирования аминогруппы, что достигается использованием реакционной среды с высоким значением рН, при которых цвиттер-ион полностью превращен в карбоксилат-анион.
Рассмотрим основные реакции с участием только аминогруппы аминокислот.
1. Алкилирование осуществляют, действуя на полученные соли аминокислот алкилгалогенидами в присутствии оснований (как органических, так и неорганических).
2. Ацилирование также требует предварительного превращения цвиттер-иона в карбоксилат-анион и успешно протекает при наличии в реакционной среде эквивалента основания (основание необходимо для связывания выделяющегося при ацилировании кислого продукта — галогеноводорода или карбоновой кислоты):
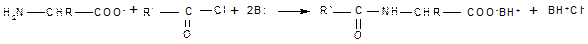
или
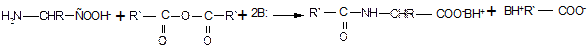
и далее

3. Образование оснований Шиффа (как типичная реакция аминов) свойственно и аминокислотам; наиболее часто используют реакции аминокислот с бензальдегидом:
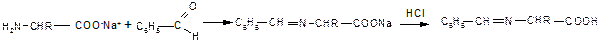
На образовании оснований Шиффа основана реакция идентификации аминокислот, известная как «нингидриновая проба», широко применяемая для визуализации зон аминокислот (возникает интенсивное сине-фиолетовое окрашивание) при их хроматографическом и электрофоретическом разделении, а также для количественного определения содержания аминокислот в растворах:
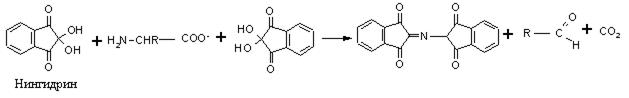
4. Дезаминирование аминокислот, как и всякого первичного амина, протекает при действии на аминокислоты азотистой кислоты:
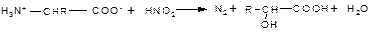
Эта реакция лежит в основе метода определения содержания азота и количества аминогрупп в аминокислотах (метод Ван-Слайка).
Биосинтез аминокислот. Все природные α-аминокислоты делят на незаменимые (валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин), которые поступают в организм только из внешней среды, и заменимые, синтез которых происходит в организме.
Биосинтез α-аминокислот может происходить на основе не аминокислот, например по реакции восстановления 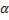 -кетокислот под действием НАДН:
-кетокислот под действием НАДН:
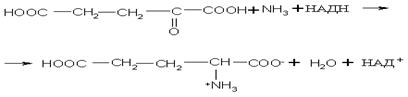
Реакция стереоспецифична вследствие стереоспецифичности НАДН.
В качестве исходных веществ при биосинтезе аминокислот могут выступать другие аминокислоты. Например, реакция трансаминирования (переаминирования) является основной при синтезе α-аминокислот в организме:
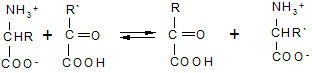
Катализаторами и участниками этого процесса являются ферменты (аминотрансферазы) и кофермент пиридоксальфосфат, который служит переносчиком аминогруппы.
§ 8.2. Пептиды.
Амино- и карбоксильные группы аминокислот могут реагировать друг с другом, даже если они находятся в одной молекуле. Еще более реальным является образование межмолекулярной амидной связи. Амиды, образовавшиеся в результате взаимодействия некоторого числа аминокислот, называют пептидами. В зависимости от числа аминокислотных остатков различают ди-, три-, тетра-, пентапептиды и т.д. При этом пептиды молекулярной массой не более 10 000 называют олигопептидами; молекулярной массой более 10 000 — полипептидами, или белками. Амидные связи в составе пептидов называют пептидными.
Пептидная группировка характеризуется рядом свойств.
1. Пептидная группировка имеет жесткую планарную структуру, т. е. все атомы, входящие в нее, располагаются в одной плоскости.
2. Атомы кислорода и водорода пептидной группировки природных пептидов и белков находятся в транс-положении по отношению к связи С—N, так как при транс-конфигурации заместителей боковые цепи оказываются наиболее удалены друг от друга, что важно для стабилизации структуры белковой молекулы.
3. Пептидная группа представляет собой трехцентровую ρ,π-сопряженную систему, которая образуется вследствие делокализации электронной плотности между атомами кислорода, углерода и азота. Длины связей С—О и С—N оказываются практически одинаковыми.
4. Пептидная связь устойчива при температуре 310 К в средах, близких к нейтральной (физиологические условия). В кислой и щелочной средах связь подвергается гидролизу. В условиях организма гидролиз происходит ферментативно.
5. Дополнительные, как правило, нековалентные связи между пептидной группой и боковыми цепями обусловливают существование различных конформаций белковой молекулы. Например, внутримолекулярные водородные связи 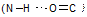 стабилизируют вторичную структуру белка.
стабилизируют вторичную структуру белка.
6. Пептидная группировка может существовать в двух резонансных формах (кетонной и енольной):

Эти свойства пептидной группировки определяют строение полипептидной цепи:
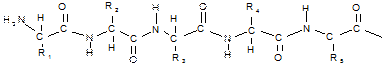
Полипептидная цепь состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков — боковых радикалов аминокислотных остатков. Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N-конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С-конец).
Как правило, при изображении формулы пептида N-конец располагают слева, а С-конец — справа:
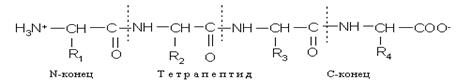
Называют пептид, последовательно перечисляя, начиная с N-конца, названия аминокислот, входящих в пептид; при этом суффикс «ин» заменяют на суффикс «ил» для всех аминокислот, кроме С-концевой.
Для описания строения пептидов применяют не традиционные структурные формулы, а сокращенные обозначения, позволяющие сделать запись более компактной.
Понятие «строение пептида» (равно как и «структура белка») включает в себя следующие характеристики:
1) общее число аминокислотных остатков;
2) перечень аминокислот, входящих в состав пептида, и указание количества аминокислотных остатков каждого вида (этот параметр называют аминокислотным составом пептида или белка);
3) последовательность связывания аминокислот друг с другом (этот параметр называют аминокислотной последовательностью; он отражает так называемую первичную структуру пептида или белка); последовательность записывают слева направо от N-конца к С-концу.
Дата добавления: 2019-09-30; просмотров: 718;











