Кислотно-основные свойства.
Карбоновые кислоты вследствие большой полярности и поляризуемости связи О—Н проявляют кислотные свойства, что отражается в их названии. В водных растворах происходит диссоциация этой связи с образованием гидратированных частиц: протона и аниона, называемого карбоксилат-анионом:
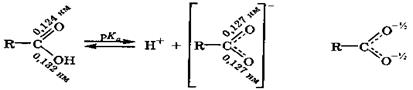
|
В карбоксилат-анионе отрицательный заряд равномерно распределяется между обоими кислородными атомами из-за делокализации электронной плотности в сопряженной системе, что увеличивает стабильность этой частицы.
Сила карбоновых кислот зависит от природы заместителей в углеводородном радикале и от стабильности образующегося аниона. Так, электронодонорные заместители (+I-эффект) ослабляют кислотные свойства, потому что уменьшают частичный положительный заряд на углеродном атоме карбоксильной группы (ср. рКа НСООН и СН3СООН). Электроноакцепторные заместители (-I-эффект), оттягивая на себя электронную плотность, способствуют усилению кислотности карбоновых кислот, так как одновременно увеличивают частичный положительный заряд на углеродном атоме карбоксильной группы и стабилизируют карбоксилат-анион из-за большей делокализации отрицательного заряда:
СН3СООН НСООН СlСН2СООН O2NCH2COOH С12СНСООН С13ССООН
рКa 4,7 3,75 2,85 1,7 1,25 0,66
——————————————————————→
увеличение кислотности
Карбоновые кислоты являются более сильными кислотами (рКа = 4,0÷5,0), чем угольная кислота (рКа = 6,3). Поэтому с их помощью можно выделять угольную кислоту (практически СО2) из карбонатов:
Na2CO3 + 2СН3СООН → 2CH3COONa + Н2О + CО 2↓
Реакции нейтрализации и гидролиза солей.Под действием щелочей карбоновые кислоты вступают в реакцию нейтрализации :
RCOOH + NaOH <=> RCOONa + Н2О
В щелочной среде равновесие сильно смещено в направлении продуктов. Обратная реакция, т.е. гидролиз солей карбоновых кислот, проявляется в водных растворах солей и приводит к частичному образованию этих относительно слабых кислот и к повышению рН раствора (рН > 7). Смеси карбоновых кислот с их солями образуют буферные системы.
|
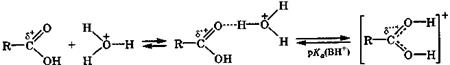
Основные свойства.В кислой среде (рН < 2) диссоциация незамещенных карбоновых кислот практически не происходит, но образуются их ассоциаты с катионом гидроксония по карбонильному кислородному атому за счет достаточно прочной водородной связи. При очень сильном увеличении кислотности среды такой ассоциат превращается в катион карбоновой кислоты:
δ+< δ'+< δ''+ ассоциат катион
с водородной связью карбоновой кислоты
Основность карбоновых кислот [рКа(ВН+) ≈ -6] сравнима с основностью кетонов, но значительно ниже основности спиртов или простых эфиров [рКа(ВН+) ≈ -2...-4]. В растворе 70 % серной кислоты будет протонировано около 50 % молекул карбоновой кислоты. Образование ассоциата с водородной связью и особенно катиона карбоновой кислоты приводит к значительному увеличению положительного заряда на карбонильном атоме углерода и повышает его электрофильную активность в реакциях нуклеофильного замещения группировки ОН карбонильной группы.
Дата добавления: 2019-09-30; просмотров: 635;











