Основания Бренcтеда.
Основания Бренcтеда для образования ковалентной связи с протоном должны содержать или электроны π-связи или свободную электронную пару, в качестве которой чаще всего используется n-электроны гетероатомов — О, N, S, галогенов и других элемен-
тов.
Основания Бренcтеда делятся на две группы: π-основания и n-основания (ониевые).
В π-основаниях, к которым относятся алкены, алкадиены, арены,центром основности, т.е. местом присоединения протона являются электроны π-связи. Это очень слабые основания, так как протонируемые электронные связи не свободны.
Ониевые основания (n-основания) классифицируются в зависимости от природы гетероатома, к неподеленной паре электронов которого присоединяется протон,т.е. в зависимости от центра основности:
а) аммониевые (центр основности — < , =
< , =  — , ≡
— , ≡  ) -первичные R
) -первичные R  H2, вторичные R2
H2, вторичные R2  и третичные R3
и третичные R3  алифатические и ароматические амины, азометины RCH=NR, нитрилы RC ≡
алифатические и ароматические амины, азометины RCH=NR, нитрилы RC ≡  , гетероциклические азотсодержащие соединения (пиридин);
, гетероциклические азотсодержащие соединения (пиридин);
б) оксониевые (центр основности — 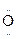 — , =
— , = 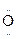 ) — спирты R
) — спирты R 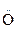 H , простые эфиры r
H , простые эфиры r 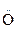 r, альдегиды
r, альдегиды  , кетоны
, кетоны 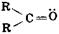 , функциональные производные кислот
, функциональные производные кислот 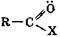 (Х = ОR, NH2, галогены, например
(Х = ОR, NH2, галогены, например  );
);
в) сульфониевые (центр основания —  —) – тиоспирты R
—) – тиоспирты R  H, тиоэфиры (сульфиды) r
H, тиоэфиры (сульфиды) r  r.
r.
Следовательно: электрофильные реагенты, имеющие свободную орбиталь, можно рассматривать как кислоты, а нуклеофильные реагенты, имеющие избыток электронов, можно рассматривать как основания. Эти понятия сходные, но не идентичные.
Различия:нуклеофильные регенты подают электроны на положительно заряженный углерод - карбокатион, а основания отдают электроны для связи с Н+ (протоном). Сильные основания не обязательно бывают хорошими нуклеофилами, и наоборот.
Аналогичное рассуждение верно для электрофильных реагентов.
Для характеристики органического соединения используют рКа (кислотность) и рКb (основность). Зависимость обратно-пропорциональная: чем слабее кислота, тем больше сила сопряженного с ней основания, и наоборот.
Таблица 8
Величины рКа некоторых кислот и рКb сопряженных с ними оснований в разбавленных водных растворах
| рКа | Кислота | Сопряженное основание | рКb |
| -5,0 | HClO4 | ClO 
| 19,0 |
| -2,8 | H2SO4 | H2SO 
| 16,8 |
| -1,74 | H3O+ | H2O | 15,74 |
| -1,32 | HNO3 | NO 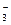
| 15,32 |
| 2,12 | H3PO4 | H3PO 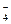
| 11,88 |
| 3,14 | HF | F- | 10,86 |
| 4,76 | CH3COOH | CH3COO- | 9,24 |
| 7,05 | H2S | HS- | 6,95 |
| 9,25 | NH4 | NH3 | 4,75 |
| 9,22 | HCN | CN- | 4,78 |
| 15,74 | H2O | HO- | -1,74 |
| NH3 | NH 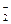
| ~-19 | |
| H2 | H- | -24 | |
| CH4 | CH 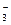
| ~-44 |
Дата добавления: 2019-09-30; просмотров: 523;











