Кислотность по Бренстеду
Кислотность и основность является не абсолютными, а относительными свойствами соединений: кислотные свойства обнаруживаются лишь в присутствии оснований, основные свойства — только в присутствии кислот.
Реакцию между кислотой и основание в общем виде можно представить следующим образом:
А- Н + :В <=> а- + В+-Н
кислота основание сопряженное сопряженная
основание кислота
Из обратимости реакции следует, что каждая кислота (А—Н и В—Н), отдавая протон, превращается в основание (А- и :В) и, наоборот, каждое основание (:В и А-), присоединяя протон превращается в кислоту и (В—Н, и А—Н соответственно). Кислота А—Н и сопряженное основание А-, а также основание :В и сопряженная кислота В—Н, связанные процессами присоединения и отщепления протона, образуют кислотно-основные пары. Кислота и основание в кислотно-основной паре взаимосвязаны: чем сильнее (слабее) кислота, тем слабее (сильнее) сопряженое основание. Например, хлороводородная кислота НCl сильнее, чем циановодородная кислота HCN, и поэтому цианид-ион CN- будет более сильным основанием, чем хлорид-ион С1- .
Кислоты Бренстеда.Кислотность обычно определяется по отношению к воде как к основанию. Количественно она оценивается константой равновесия (К) реакции, заключающейся в переносе протона от кислоты к основанию (протолитическая реакция):
CH3COOH + H2O <=> CH3COO- + H3O+
Уксусная Основание ацетат-ион ион гидроксония
кислота (избыток) сопряженное (сопряженная
основание кислота)
Константа равновесия этой реакции равна:
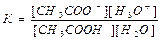
Концентрация воды постоянна, и произведение К-[ Н2О] называют константой кислотности и обозначают Ка Таким образом, константа кислотности Ка определяется по следующему уравнению:
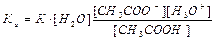
Чем больше величина Ка, тем сильнее кислота. Для уксусной кислоты Ка равна 1,75·10-5. Такие малые величины неудобны в практической работе, поэтому используют отрицательный логарифм —lg Ка= рКа (например, для уксусной кислоты рКя = 4,75). Очевидно, что чем меньше величина рКа, тем сильнее кислота.
В зависимости от природы элемента, с которым связан протон, т.е. в зависимости от строения кислотного центра, бренстедовские кислоты делятся на четыре основные типа:
О-Н - кислоты: карбоновые кислоты, фенолы, спирты;
S-H - кислоты: тиолы;
N-H - кислоты: амиды, амины, имиды;
С-Н - кислоты: углеводороды и их производные.
Таблица 7
Дата добавления: 2019-09-30; просмотров: 604;











