Константа равновесия
Количественной характеристикой равновесного состояния является
величина, называемая константой равновесия (Кр). В состоянии равновесия состав системы не меняется, т. е. концентрации реагентов и продуктов реакции остаются постоянными (они называются равновесными).
В 1864 г. норвежские ученые К. Гульдберг и П. Вааге сформулировали закон действующих масс (ЗДМ): отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ (реагентов) в степенях, равных стехиометрическим коэффициентам, при Т = const, является величиной постоянной.
Рассмотрим обратимую химическую реакцию общего вида, в которой все вещества находятся в одном агрегатном состоянии, например, жидком:
аA + вB D сC + dD,
где A и B – исходные вещества прямой реакции; C и D – продукты прямой реакции; а, в, с, и d – стехиометрические коэффициенты.
В начальный момент времени, когда концентрация веществ A и B наибольшая, скорость прямой реакции также будет наибольшей и по закону действующих масс равна
uпр = k1CАаCВв (1)
где k1 – константа скорости прямой реакции.
С течением времени концентрация веществ A и B уменьшается, а, следовательно, уменьшается и скорость прямой реакции.
В начальный момент времени концентрация веществ C и D равна нулю, а, следовательно, и скорость обратной реакции равна нулю, с течением времени концентрация веществ C и D возрастает, а, следовательно, возрастает и скорость обратной реакции и она будет равна
uобр = k2CCсCDd (2)
где k2 – константа скорости обратной реакции.
В момент достижения равновесия, концентрации принимают значение равновесных, а скорости равны между собой uпр = uобр, следовательно
k1CАаCВв = k2CCсCDd (3)
Перенесем константы скорости в одну сторону, а концентрации в другую:
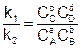 (4)
(4)
Отношение двух постоянных величин есть величина постоянная, и называется она константой химического равновесия:
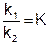 (5)
(5)
Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции.
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Величина константы равновесия зависит от природы реагирующих веществ и температуры, и не зависит от концентрации в момент равновесия, поскольку их отношение – всегда величина постоянная, численно равная константе равновесия. Если гомогенная реакция идет между веществами в растворе, то константа равновесия обозначается KС, а если между газами, то KР.
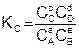 (6)
(6)
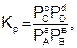 (7)
(7)
где РС, РD, РА и РВ – равновесные давления участников реакции.
Используя уравнение Клапейрона-Менделеева, можно определить связь между KР и KС
рV = nRT (8)
Перенесем объем в правую сторону
р = 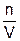 RT, т. е. р = CRT (9)
RT, т. е. р = CRT (9)
Дата добавления: 2021-02-19; просмотров: 467;











