Электрохимическая коррозия
Электрохимическая коррозия металла может проявиться в тех случаях, когда имеет место граница раздела фаз металл-электролит. Факт проявления коррозии не зависит от природы электролита, будь это сверхчистая вода или расплавленная соль. Не имеет существенного значения и количество электролита - в предельном случае это может быть пленка влаги толщиной в несколько десятков миллимикрон.
Схема процесса коррозии.Анодный процесс при коррозии всегда заключается в ионизации металла. Металл переходит в раствор в виде гидратированных ионов, при этом в металле остается соответствующее число электронов.
Примерами анодных реакций могут быть:
Fe - 2ē = Fe2+ - окисление железа
Al - 3ē = Al3+ - окисление алюминия
В общей форме реакция выглядит так:
Me – nē = Men+, где Me - металл.
Катодный процесс - поглощение появившихся в металле избыточных электронов с помощью так называемых деполяризаторов, которыми могут являться атомы, молекулы, ионы раствора, подвергающиеся восстановлению на всей поверхности металла или отдельных ее участках.
Примерами катодных реакций могут быть следующие:
2Н+ + 2ē → 2Н → Н2 - восстановление ионов водорода в кислой среде.
О2 + 4Н+ + 4ē → 2Н2О - восстановление растворенного кислорода в кислой среде.
О2+2Н2О + 4ē → 4ОН- - восстановление растворенного кислорода в нейтральной или щелочной среде.
В общей форме уравнение катодной реакции выглядит так:
D + ē → D, где D – деполяризатор.
Поляризация и ее виды. Коррозия металлов с кислородной и водородной деполяризацией.При прохождении через электрод электрического тока извне происходит смещение его потенциала. Численная величина изменения потенциала вследствие прохождения тока называется поляризацией.
Причина возникновения поляризации состоит в том, что переход зарядов из металла в раствор и перемещение ионов в электролите встречают определенное сопротивление. В зависимости от вызывающих его факторов различают три вида по-
ляризации: концентрационную, активационную и оммическую.
Причиной концентрационной поляризации является разность концентраций ионов в приэлектродном пространстве, следствием чего является изменение потенциала электрода.
Возникновение активационной поляризации обусловлено сопротивлением, возникающим во время катодной реакции присоединения электронов деполяризатором или торможением
при переходе катионов из металлической решетки в раствор. В электрохимии эти процессы называют стадиями, считается, что самая замедленная стадия определяет скорость процесса. Преодоление такого сопротивления требует добавочной активационной энергии, поэтому и поляризация называется активационной.
Омической поляризацией называется падение потенциала JR, вызываемое электрическим сопротивлением слоя электролита вблизи электрода или слоя продуктов реакции, а также обоих этих слоев одновременно.
В зависимости от направления сдвига потенциала электрода при прохождении постоянного тока различает анодную и катодную поляризации. Анодной поляризацией называется сдвиг потенциала в положительную сторону, катодной поляризацией - его перемещение в отрицательную сторону.
На практике всегда стремятся к увеличению поляризации в коррозионном элементе. Благодаря поляризации металлов скорость коррозии уменьшается в сотни, а то и в тысячи раз.
Явление, противодействующее поляризации электрода, принято называть деполяризацией. Деполяризация (анодная и катодная) ускоряет процесс коррозии.
Среди большого количества реакций катодной поляризации в коррозионных процессах наибольшее значение имеют реакции, в которых в роли, деполяризатора выступает кислород (кислородная деполяризация) или ионы водорода: водородная поляризация).
С водородной деполяризацией протекает коррозия всех
металлов, стоящих левее водорода в ряду напряжений, в кислых средах. В нейтральных средах с водородной деполяризацией протекает коррозия активных металлов, а в щелочных средах - амфотерных металлов.
С кислородной деполяризацией протекает коррозия металлов малой и средней активности в нейтральных средах и в любых средах металлов малой активности, т.е. стоящих в ряду
напряжений после водорода. С кислородной деполяризацией протекает атмосферная и почвенная коррозия. Существенное влияние на скорость коррозии оказывает скорость доставки кислорода к металлу путем диффузии или конвекции, а также такие факторы как перемешивание электролита, глубина погружения корродирующего металла, растворимость кислорода в растворе и т.д.
Причины возникновения гальванопар.В процессах электрохимической коррозии можно выделить следующие типы возникновения гальванических пар (т.е. разности потенциалов на поверхности металлов):
1. Практически любой металл содержит примеси других металлов или соединения того же металла. В среде электролита система из основного металла и металла примеси образует большое число гальванопар. Участки с более электроотрицательными потенциалами окажутся анодами (по отношению к внутреннему участку цепи) и будут растворяться, a нa более электроположительных участках (катодах) будут происходить процессы восстановления. Таким образом, одной из причин электрохимической коррозии является возникновение микро - и макрогальваничесхих элементов на поверхности металла.
На рис. 69 представлена схема коррозии железа с включением меди.
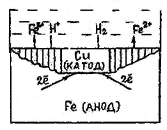
Рис.69. Схема коррозии железа с включением меди
Электрохимическая система этой гальванопары в электролите изображается, как и в случае гальванического элемента, схемой
A (-) Fe│H2SO4│Cu (+) K
железо - анод, медь - катод
На аноде: Fe - 2ē = Fe2+
На катоде: 2Н+ + 2ē = Н2
В результате железо разрушается в месте контакта, а на меди выделяется водород.
2. Гальванопары могут возникать и в результате неравномерности аэрации, т.е. неравномерного доступа кислорода к различным участкам поверхности металла. На рис. 70 показана схема коррозии железа при неравномерном доступе кислорода.
Участки поверхности металла, к которым быстрее диффундирует кислород - катодные, к которым затрудняется доступ кислорода – анодные.
На аноде: Fe - 2ē = Fe2+
На катоде: O2 + 2Н2O + 4ē = 4ОН- (в нейтральной среде)
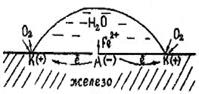
Рис. 70. Схема коррозии железа при неравномерной аэрации
В ходе коррозии химический состав раствора вблизи металлической поверхности подвергается непрерывным изменениям. Результатом этих изменений являются вторичные реакции. Из приведенной выше схемы видно, что вблизи катодного участка происходит подщелачивание и ионы железа могут вступить в реакцию с ионами OН- с образованием гидроокиси железа: Fe2+ + 2OH- → Fe (OH)2
Труднорастворимая гидроокись железа выпадает в осадок. Если процесс протекает в воздушной среде, то гидроокись железа (II) окисляется кислородом воздуха в гидроокись железа (III):
4Fe (OH)2 + O2 + 2H2O → 4Fe (OH)3
Гидроксиды железа неустойчивы и постепенно могут переходить в соответствующие оксиды. Продукты электрохимической коррозии железа, состоящие из гидратированных оксидов, называются ржавчиной.
3. Возникновение разности потенциалов может наблюдаться для одного и того же металла, части которого контактируют с электролитом разной концентрации. В растворе с меньшей концентрацией поверхность металла заряжается отрицательно (анод), а в более концентрированном растворе - положительно (катод).
4. Часто детали изделия, выполненные из одного и того же металла и различающиеся только по температуре эксплуатации могут подвергаться электрохимической коррозии. Такие контакты встречаются в промышленных устройствах, соприкасающихся с нагретыми газами или жидкостями, например, в паровых котлах, змеевиках и т.д.
5. Различный уровень механических напряжений в одной и той же детали приводит к возникновению микрогальванопар. Если согнутая металлическая пластинка погружена в коррозионную среду, то на растянутом слое через некоторое время начнут возникать трещины (анод), внутренний слой останется без изменения (катод).
Факторы, влияющие на коррозию.На скорость коррозии влияют различные факторы: природа металла, его структу-
ра и состояние поверхности, химический состав и свойства среды, температура электролита, природа поверхностных оксидных пленок, условия работы изделия, влажность, пыль и др. Например, состав электролита определяет электропроводность и активную концентрацию ионов, участвующих в процессе.
Ускоряют коррозионные процессы во всех случаях и для всех металлов ионы Н+, Сl -, Br -, I -, понижая потенциал растворения металлов. Для амфотерных металлов такую роль играют ионы ОН -.
Присутствие в электролите ионов или полярных молекул, которые могут выступать как лиганды при комплексообразовании и растворять пассивирующие пленки (Сl -, СN -, NH3), значительно ускоряет коррозионные процессы.
С увеличением температуры скорость коррозии металлов, как правило, возрастает, причем эта зависимость носит экспоненциальный характер. Скорость коррозии стали в НСl, идущая с выделением водорода, удваивается при увеличении температуры на 10°. Однако часто зависимость скорости коррозии от температуры имеет сложный характер (например, в случае, когда процесс коррозии протекает с кислородной деполяризацией). Такое явление наблюдается при коррозии стали в природных водах.
Дата добавления: 2016-12-09; просмотров: 5002;











