Методы защиты от электрохимической коррозии
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, снижением концентрации окислителя, изменением состава металла и др. При разработке методов защиты от коррозии используют указанные способы снижения скорости коррозии, которые меняются в зависимости от характера коррозии и условий ее протекания. Выбор способа определяется его эффективностью, а также экономической целесообразностью. Все методы защиты условно делятся на следующие группы: а) легирование металлов;
б) защитные покрытия (металлические, неметаллические), электро - химическая защита; в) изменение свойств коррозионной среды; г) рациональное конструирование изделий.
Легирование металлов - эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла. В качестве таких компонентов применяют хром, никель, вольфрам и др. Широкое применение нашло легирование для защиты от газовой коррозии. При этом используют сплавы, обладающие жаростойкостью и жаропрочностью.
Защитные покрытия - это слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии. Материалы для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примера катодных покрытий на стали можно привести Сu, Ni, Ag. При повреждении покрытия (или наличие пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия - катодом, на котором выделяется водород или поглощается кислород (рис. 71).
Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия сможет служить цинк на стали. В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует (рис. 72).
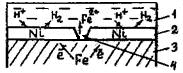
Рис. 71. Схема коррозии металла в кислом растворе при
нарушении катодного покрытия: 1 - раствор, 2 - покрытие,
3 - основной металл, 4 – пора.
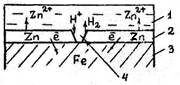
Рис. 72. Схема коррозии металла в кислом растворе при
нарушении анодного покрытия: 1 - раствор, 2 - покрытие,
3 - основной металл, 4 - пора
Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия. Так, покрытие стали оловом в растворе Н2SO4 - катодное, а в растворе органических кислот – анодное.
Для получения металлических защитных покрытий применяются  различные способы: электрохимический (гальванические покрытия), погружение в расплавленный металл, металлизация термодиффузионная и химическая.
различные способы: электрохимический (гальванические покрытия), погружение в расплавленный металл, металлизация термодиффузионная и химическая.
Электрохимическая защита основана на торможении анодных или катодных реакций коррозионного процесса. Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала - протектора, а также катодной или анодной поляризацией за счет извне приложенного тока.
Защита от коррозии с использованием протектора называется протекторной. Она осуществляется следующим способом: защищаемое изделие (например, Fe) соединяется металлическим проводником с более активным металлом (например, Zn). Возникает гальванический элемент, где Zn является анодом, растворяется, Fe - оказывается защищенным (катод).
Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод. Вспомогательный электрод растворяется на защищаемом сооружении (катоде) выделяется водород.
При анодной защите защищаемое изделие присоединяется к аноду внешнего источника тока. Подбирают определенную плотность тока, чтобы металл не растворялся, а на аноде в результате электролиза выделялся кислород. Защищаемый металл покрывается оксидной пленкой. анодная защита применяется к легкопассивирующим металлам (Al, Mg, Cr, и др.).
Эффективным способом защиты от коррозии является применение неметаллических покрытий. К этим покрытиям относятся:
а) Оксидные пленки. Нанесение оксидных пленок осуществляется электрохимическим и химическим путем.
б) Труднорастворимые химические пленки. Широко применим процесс форфатирования. На поверхности изделия создается фосфатная пленка, обладающая не только коррозионной устойчивостью, но и высокими электроизоляционными свойствами.
в) К неметаллическим покрытиям относятся всевозможные эмали, смазки, лаки, краски, высокомолекулярные соединения.
Для снижения скорости коррозии часто изменяют свойства коррозионной среды. Агрессивность среды снижают уменьшением концентрации опасных в коррозионном отноше-
нии компонентов, а также снижением концентрации ионов водорода. Для защиты от коррозии широко применяют ингибиторы коррозии - вещества, при добавлении которых в агрессивную среду, значительно уменьшается скорость коррозии металлов. Различают анодные и катодные ингибиторы. К анодным ингибиторам относятся те, которые замедляют действие коррозии, например, нитрит натрия NaNO2, дихромат натрия Na2Cr2O7. Их действие сводится к образованию пленки труднорастворимого соединения, либо к окислению поверхности металла, либо к адсорбции на поверхности металла.
Катодные замедлители уменьшают скорость коррозии за счёт снижения интенсивности катодного процесса или к сокращению площади катодных участков. К катодным ингибиторам относятся органические вещества, содержащие азот, серу и кислород, например, диэтиламин, уротропин, формальдегид и др.
Рациональное конструирование изделий должно исключать наличие или сокращать число и размеры особо коррозионноопасных участков в изделиях или конструкциях, а также предусматривать специальную защиту металла этих участков от коррозии.
РАЗДЕЛ ЧЕТВЕРТЫЙ
ИЗБРАННЫЕ ВОПРОСЫ ХИМИИ
Дата добавления: 2016-12-09; просмотров: 2937;











