Полупроводников и диэлектриков
Элементарные металлы являются проводниками электричества первого рода. Способность металлов проводить электричество - их электрическая проводимость обусловлена наличием в них кристаллических решетках электронов, находящихся в состоянии проводимости. Энергетическое состояние электронов проводимости обусловлено расщеплением электронных уровней в зависимости от расстояния между центрами атомов в кристалле (рис. 73). Наличие электронов проводимости может быть доказано посредством исследования эффекта Холла. Электроны, двигающиеся в электрическом поле, меняют направление в зависимости от приложенного магнитного поля, создавая поперечную разность потенциалов; измерив последнюю, можно вычислить число электронов проводимости на один атом.

Рис. 73. Расщепление энергетических уровней атома
в зоны при взаимодействии атомов в твердом теле
Взаимодействие электронов проводимости с ионами металла, находящимися в узлах кристаллической решетки, обуславливает большую теплопроводность металла.
Электроны проводимости в металлическом кристалле обладают большой подвижностью, однако за фазовую границу металлического кристалла они не проникают. Для преодоления этой границы необходимо затратить энергию, называемую работой выхода электрона. Эта энергия может быть получена электронами в результате освещения или нагревания металла. При освещении поверхности металла от нее отрываются электроны; такое явление называют фотоэлектрическим эффектом. Очевидно, что отрыв электронов при фотоэлектрическом эффекте обусловлен энергией кванта света, падающего на поверхность металла.
На границе раздела двух различных металлов возникает контактная разность потенциалов. Ее возникновение обусловлено различной концентрацией электронов проводимости к различной работой выхода электронов у соприкасающихся металлов. Некоторые пары металлов обладают значительной контактной разностью потенциалов. Величина контактной разности потенциалов существенно зависит от температуры. В зависимости от поведения металлов в магнитном поле различают диамагнитные, парамагнитные и ферромагнитные металлы. Мерой магнитных свойств металлов, как и других веществ, служит магнитная восприимчивость, которая определяется восприимчивостью вещества к магнитным силовым линиям. Металлы с отрицательной восприимчивостью оказывают большее сопротивление магнитным силовым линиям, чем пустое пространство, и называются диамагнитными; металлы с положительной восприимчивостью хорошо проводят магнитные силовые линии и называются парамагнитными. Диамагнитные вещества, помещенные между полюсами сильного магнита, ориентируются перпендикулярно, а парамагнитные вещества - вдоль силовых линий. Металлы с особо высокой
магнитной восприимчивостью (например, железо) называются ферромагнитными. Парамагнитные металлы втягиваются в магнитное поле, а диамагнитные выталкиваются из него. Диа-
магнитным является, например бериллий и металлы подгрупп цинка, галлия, германия. Парамагнитными являются - щелочные, щелочноземельные и металлы побочных подгрупп периодической системы; ферромагнитных металлов немного - это железо, кобальт, никель, гадолиний и диспрозий. Ферромагнитные свойства металлов сохраняются лишь до определенной критической температуры, называемой точкой Кюри, выше которой остаются лишь обычные парамагнитные свойства.
Непрозрачность металлов также обусловлена присутствием в кристаллической решетке (а также и в расплаве) свободных электронов. Подвижные электроны в металле гасят световые колебания, превращая их энергию в теплоту или, в определенных условиях, используя ее для высвобождения электронов с поверхности металла (фотоэлектрический эффект). Как известно, металлический блеск объясняется тем, что металлы отражают большую долю падающего на них света. Интенсивность блеска определяется долей поглощаемого света. Наиболее ярко блестят палладий и серебро. Большинство металлов почти полностью отражает свет всех длин волн спектра, в связи с чем они имеют белый или серый цвет. И только некоторые металлы (медь, золото, цезий) поглощают зеленый или голубой свет сильнее, чем свет других длин волн, в связи с чем, они окрашены в желтый или даже красный цвет. Этим объясняется способность всех металлов полностью отражать радиоволны, которая используется для обнаружения различных металлических объектов с помощью радиоволн (радиолокация).
Металлы относятся к веществам с очень хорошей электронной проводимостью (проводники первого рода). Их удельная электропроводность 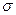 от 104 до 106 ом-1∙см-1, или в системе СИ от 106 до 108 сим∙м-1 (1 сим = 1 ом-1). Несколько
от 104 до 106 ом-1∙см-1, или в системе СИ от 106 до 108 сим∙м-1 (1 сим = 1 ом-1). Несколько
меньшей проводимостью, чем чистые металлы, обладают их сплавы, некоторые интерметаллические соединения и различные карбиды, гидриды, нитриды металлов, являющиеся фазами переменного состава. Удельная проводимость металлов выражается уравнением
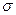 = neu,
= neu,
где n -концентрация электронов проводимости, см-3; е -
- заряд электрона, равный 1,6∙10-19 к, u -подвижность электронов, см2 / (в∙сек).
Если число атомов в 1 см3 металла порядка 1022, число валентных электронов каждого атома единица, то 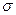 при u = 100 см2 / (в∙сек) бдет порядка 105 ом-1∙см-1.
при u = 100 см2 / (в∙сек) бдет порядка 105 ом-1∙см-1.
Так как концентрация электронов проводимости n в данном металле практически постоянна и не зависит от температуры, то 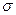 будет зависеть только от тех факторов, которые влияют на подвижность электронов u. В частности, при повышении температуры увеличивается амплитуда колебаний положительных ионов металлической решетки. Из-за этого более интенсивно рассеиваются электроны и уменьшается их подвижность, вследствие чего электропроводность металлов при нагревании уменьшается. Наоборот, при приближении к абсолютному нулю уменьшается амплитуда колебания ионов, кристаллическая решетка упорядочивается, уменьшается влияние ионов на электроны проводимости и облегчается продвижение последних в металле. Многие металлы в силу особых квантовых условий при низких температурах становятся сверхпроводниками.
будет зависеть только от тех факторов, которые влияют на подвижность электронов u. В частности, при повышении температуры увеличивается амплитуда колебаний положительных ионов металлической решетки. Из-за этого более интенсивно рассеиваются электроны и уменьшается их подвижность, вследствие чего электропроводность металлов при нагревании уменьшается. Наоборот, при приближении к абсолютному нулю уменьшается амплитуда колебания ионов, кристаллическая решетка упорядочивается, уменьшается влияние ионов на электроны проводимости и облегчается продвижение последних в металле. Многие металлы в силу особых квантовых условий при низких температурах становятся сверхпроводниками.
Примеси в металле нарушают строение кристаллической решетки. Проводимость такого металла оказывается меньше, чем чистого. Именно по этой причине приходится, например, медь, идущую для изготовления проводов, тщательно очищать электролитическим рафинированием.
Диэлектрики в противоположность металлам характеризуются жесткой локализацией валентных электронов около определенных атомов, находящихся в ковалентной связи с соседними атомами. В типично ионных решетках электроны тоже прочно удерживаются около каждого иона. По этой причине диэлектрики имеют очень малую удельную электропроводность (от 10-10 до 10-22 ом-1 ∙ см-1) и обладают изолирующими свойствами.
К диэлектрикам относятся некоторые простые вещества (алмаз), подавляющее большинство органических соединений, керамические материалы, слюда, силикатные стекла и др. Особо важное значение имеют полимерные материалы как диэлектрики, используемые в качестве хороших изоляторов. К газообразным диэлектрикам относятся N2, SF6 и др. В состав диэлектриков могут входить атомы металлических элементов, но атомы неметаллов входят обязательно, так как без них не существуют прочные ковалентные, ионные или ионно-ковалентные связи между атомами. Таких связей нет только в ожиженных и закристаллизованных газах нулевой группы элементов периодической системы, которые также обладают свойствами диэлектриков.
Между металлами, как очень хорошими электронными проводниками, и диэлектриками, обладающими более или менее высокими изолирующими свойствами, находится громадная группа веществ с удельной электропроводностью от 10-10 до 104 ом-1см-1. Вещества этой группы называют полупроводниками. Под полупроводниками понимают обычно неметаллические проводники с электронным механизмом тока.
Сравнивая свойства их с металлами и диэлектриками, можно нагляднее всего характеризовать полупроводники.
При повышении температуры проводимость полупроводников в отличие от металлов обычно возрастает. Электропроводность диэлектриков тоже возрастает. При температуре, близкой к абсолютному нулю, проводимость полупроводников
и диэлектриков практически нулевая. По электрическим свойствам полупроводники стоят ближе к диэлектрикам, чем к металлам, от которых они имеют принципиальное качественное отличие.
По сравнению с металлами проводимость полупроводников не уменьшается, а увеличивается при введении ничтожных количеств примесей, при появлении других дефектов строения кристаллической решетки, при действии различных излучений. Электрофизические свойства полупроводниковых соединений весьма чувствительны к отклонениям от стехиометрического состава. В отличие от металлов полупроводники хрупки и менее теплопроводны, хуже отражают видимые лучи.
Малая проводимость их по сравнению с металлами вызвана не тем, что подвижность носителей заряда сильно отличается в металлах и полупроводниках, а главным образом тем, что ток в последних переносится небольшой частью электронов, например, стомиллионной долей от общего числа валентных электронов. Уменьшение 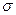 при охлаждении полупроводников может быть объяснено только быстрым уменьшением числа электронов проводимости n, так как известно, что подвижность электронов возрастает при охлаждении. Стремление
при охлаждении полупроводников может быть объяснено только быстрым уменьшением числа электронов проводимости n, так как известно, что подвижность электронов возрастает при охлаждении. Стремление 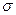 и n к нулю при Т → 0 указывает на то, что электроны проводимости в полупроводниках создаются тепловым движением (или другими видами энергии, сообщенной извне). Это основное отличие полупроводников от металлов.
и n к нулю при Т → 0 указывает на то, что электроны проводимости в полупроводниках создаются тепловым движением (или другими видами энергии, сообщенной извне). Это основное отличие полупроводников от металлов.
Объяснение электропроводности металлов, полупроводников и диэлектриков дается на основе квантовой теории строения кристаллических тел - так называемой зонной теории. Рассмотрим некоторые общие положения этой теории. Переход атомных паров в кристаллическое вещество можно рассматривать как химическую реакцию, так как оптические, термодинамические, электрофизические и другие свойства твердых тел отличаются от свойств газов. Важно отметить, что атомные спектры газов имеют линейчатое строение, а спектры твердых тел имеют сплошной характер или полосатую, очень сложную структуру. Уже при взаимодействии двух одинаковых атомов дискретные атомные энергетические уровни расщепляются и превращаются в полосы. Тем большее расщепление уровней происходит, когда большое число N атомов, например лития, сближается с далеких расстояний до расстояний, на которых они находятся в кристаллической решетке. На рис. 74, а это расстояние между ядрами обозначено на оси абсцисс буквой d0. По оси ординат отложена энергия. Находясь на больших расстояниях, атомы не взаимодействуют друг с другом, и диаграмма уровней будет такая же, как и для изолированного атома лития (ls22s1). При сближении атомов начнется взаимодействие между ними, прежде всего у каждого из них станет расщепляться уровень валентных электронов (2s). Уровень (2s) расщепляется в систему весьма близко расположенных N уровней, образуя целую полосу (зону) уровней. Более глубокие уровни при образовании кристалла оказываются совсем не расщепленными или только незначительно расщепленными.
Если ширина зоны валентных состояний в кристалле равна 1 эв, а число атомов N, образующих 1 см3 кристалла, имеет порядок 1022, то энергетические уровни в зоне расположены в среднем на расстояниях 1 / 1022 эв друг от друга. Между зонами состояний 1s и 2s в кристалле лития находится область неразрешенных состояний (запрещенная зона).
Заполнение уровней разрешенных зон электронами подчиняется принципу Паули, поэтому число электронов не может быть больше числа возможных состояний в данной зоне. Максимальное число электронов в зоне должно быть не больше qN (где q - степень вырождения исходных уровней атома. Следовательно, в зоне s могут находиться лишь 2 N электронов, так
как степень вырождения s- уровней равна двум (из-за двух различных значений спинового числа). В зоне р могут находиться максимум 6 N электронов (из-за шестикратного вырождения р - уровней) и т. д.
 |
Рис. 74. Расщепление энергетических уровней атома в зоны при взаимодействии атомов в твердом теле:
а - для лития; б - для бериллия
На основе зонной теории легко объяснима электропроводность твердого тела. Например, она объясняет электропроводность лития и других щелочных металлов У них валентная зона занята только наполовину, так как N атомов имеют N валентных электронов (по одному s- электрону на атом), а число мест в s- зоне 2 N. Незаполненность верхней (валентной) зоны порождает электронную проводимость, характерную для металла. Действительно, под влиянием электрического поля валентные электроны должны начать движение к положительному полюсу, т. е. приобретать дополнительную энергию. Такое наращивание этой энергии очень малыми порциями (почти непрерывное) возможно, если в зоне валентных состояний есть уровни, свободные от электронов. Если зона валентных состояний полностью заполнена электронами, то проводимость должна отсутствовать, т. е. тело должно иметь свойства диэлектрика. В полностью заполненной зоне электроны не могут наращивать энергию малыми порциями, так как принцип Паули запрещает переходы внутри заполненной зоны.
С этой точки зрения атомы бериллия и других элементов 2-й группы имеют полностью заполненную s- зону валентных состояний: N атомов, образующих кристалл, поставляют 2 N электронов (по два s- электрона каждый), что отвечает числу возможных состояний в зоне. Однако кристаллы этих веществ не являются изоляторами (диэлектриками) и хорошо проводят ток, как металлы. Это объясняется следующим. При сближении атомов бериллия и других элементов 2-й группы до расстояния, равного параметру решетки d0, расщепленные уровни s- и р- состояний перекрывают друг друга (рис. 74, б) и образуют объединенную зону sp- состояний, в которой имеется 8 N мест. Таким образом, верхняя sp- зона имеет только  занятых мест в кристаллах элементов 2-ой группы,
занятых мест в кристаллах элементов 2-ой группы, 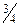 мест остаются свободными. Поэтому указанные вещества имеют металлическую проводимость. У других металлов тоже только частично заполнена электронами верхняя (валентная) энергетическая зона.
мест остаются свободными. Поэтому указанные вещества имеют металлическую проводимость. У других металлов тоже только частично заполнена электронами верхняя (валентная) энергетическая зона.
Дискретным уровням атома в твердом теле соответствует всегда дискретная система разрешенных зон, разделенных запретными зонами. Как правило, если электроны образуют в атоме или молекуле законченную группу, то при объединении их в твердое или жидкое тело создаются зоны, все уровни которых заполнены, поэтому такие вещества будут обладать при абсолютном нуле свойствами изоляторов. Сюда относятся решетки благородных газов, молекулярные и ионные решетки соединений с насыщенными связями. В решетках алмаза, кремния, германия, 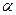 - олова, соединений типа AIIIBV, AIIBVI, CSi каждый атом связан единичными валентными связями с четырьмя ближайшими соседями, так что вокруг него образуется законченная группа электронов s2p6 и валентная зона оказывается заполненной.
- олова, соединений типа AIIIBV, AIIBVI, CSi каждый атом связан единичными валентными связями с четырьмя ближайшими соседями, так что вокруг него образуется законченная группа электронов s2p6 и валентная зона оказывается заполненной.
Полупроводники и диэлектрики отличаются от металлов тем, что валентная зона у них при Т 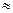 0 К всегда полностью
0 К всегда полностью
заполнена электронами, а ближайшая свободная зона (зона проводимости) отделена от валентной зоной запрещенных состояний. Ширина запрещенной зоны Δ E у полупроводников - от десятых долей электрон-вольт до 3 Эв (условно), а у диэлектриков - от 3 до 5 Эв. Если между полупроводниками и диэлектриками имеется только количественное различие, то отличие их от металлов качественное. Чтобы проходил ток в металле, не требуется никакого другого воздействия, кроме наложения электрического поля, так как валентная зона в металле не заполнена или перекрывается с зоной проводимости (рис. 75, а).
Для возбуждения проводимости в полупроводнике необходимо к электрону, находящемуся в заполненной валентной зоне, подвести энергию, достаточную для преодоления зоны запрещенных состояний. Только при поглощении энергии не меньше, чем Δ E, электрон будет переброшен из верхнего края валентной зоны в свободную зону (зону проводимости). Если этот энергетический порог преодолен, то чистый (собственно) полупроводник имеет электронную проводимость. Чем меньше ширина запрещенной зоны Δ Е, тем больше проводимость при данной температуре. Так как у диэлектриков Δ Е очень велика, то проводимость их очень мала.
При приближении к абсолютному нулю термическое возбуждение оказывается недостаточным, и полупроводники становятся диэлектриками, а металлы становятся сверхпроводниками. Чем выше температура и чем более интенсивно полупроводник облучается квантами с энергией h 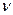 не меньше Δ Е, тем больше проводимость собственно полупроводника, так как увеличивается число электронов, перебрасываемых из валентной зоны в зону проводимости.
не меньше Δ Е, тем больше проводимость собственно полупроводника, так как увеличивается число электронов, перебрасываемых из валентной зоны в зону проводимости.
Для чистых полупроводников при убывании частоты падающего света коэффициент поглощения при некотором значении 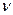 резко падает, и материал становится прозрачным для лучей с меньшими частотами. Этот участок быстрого спада поглощения называется краем собственного поглощения. Длина волны
резко падает, и материал становится прозрачным для лучей с меньшими частотами. Этот участок быстрого спада поглощения называется краем собственного поглощения. Длина волны 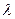 и частота
и частота 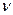 , отвечающая краю собственного поглощения, приближенно определяются условиями
, отвечающая краю собственного поглощения, приближенно определяются условиями

Рис. 75. Схема энергетических зон:
а - в металле; б - в полупроводнике; в - в диэлектрике;
Δ Е - ширина запрещенной зоны
h 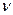 = hC /
= hC / 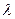 = Δ Е,
= Δ Е,
где Δ Е называется оптической шириной запрещенной зоны.
Энергия квантов видимого света лежит в пределах 1,5 - 3,0 эв, т. е. обычно превышает энергию возбуждения проводимости (Δ Е). Если в полупроводнике есть некоторое количество примесей, он становится непрозрачным в широкой области частот - от ультрафиолетовой вплоть до радиочастот.
Металлы при облучении светом практически не изменяют проводимость, так как число электронов проводимости в них не изменяется.
Уход электрона из валентной зоны полупроводника в зону проводимости оставляет свободное место (дырку) в валентной зоне с положительным зарядом, численно равным заряду электрона. Таким образом, дыркой называется освобожденное от электрона место в области нарушенной ковалентной связи, соединяющей соседние атомы собственно полупроводника, имеющее единичный положительный заряд.
На рис. 76 изображены схемы появления дырки в атомной решетке элементарного полупроводника и возникновение электрона проводимости. Электрон, появившийся в междоузлии, является подвижным носителем заряда. Такие электроны, как и дырки, могут свободно перемещаться по кристаллу (диффундировать). Если поместить кристалл в электрическое поле с напряжением, падающим справа налево, то «свободный» электрон приобретает направленное движение против поля (вправо). На место образовавшейся дырки (+) перейдет электрон из какого-либо места соседней связи левее дырки. Таким образом, образуется новая дырка вместо прежней. Следовательно, дырка перемещается по направлению поля (влево) при скачках электронов в валентной зоне, совершающихся слева направо, как показано на рис. 76, а (стрелками). Перенос заряда электронами валентной зоны называют дырочным. Таким образом, в собственных полупроводниках бывает двоякий механизм проводимости: электронный и дырочный. Удельная электропроводность полупроводника в общем случае выражается уравнением
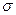 = neun + peup ,
= neun + peup ,
где un и up - подвижности соответственно электронов и дырок; n и p - их концентрации.
В собственном полупроводнике
n = p = Ae  ,
,
где k - константа Больцмана, равная 1,38∙10-16 эрг/град, или 0,863·10- 4эв/град; А для полупроводников с ковалентными связями (например, кремния и германия) пропорциональна Т1,5, а подвижности носителей заряда пропорциональны Т-1,5, поэтому без большой погрешности можно написать считая 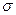 0 - постоянной величиной для данного полупроводника.
0 - постоянной величиной для данного полупроводника.
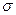 =
= 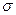 0 e
0 e  ,
,
 |
Рис. 76. Схема разрыва валентной связи и появление
свободного электрона и дырки как носителей заряда:
а - в плоском изображении; б - в зонной энергетической диаграмме; А - атомы кремния или германия; (:) - валентные электроны, осуществляющие связь соседних атомов; (+) - дырка;
(-) - свободный электрон; Ес - нижний уровень свободной зоны;
Ев - верхний уровень валентной зоны
Логарифмируя, получим
ln 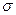 = ln
= ln 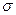 0 -
0 - 
Это уравнение прямой линии ln 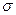 = f
= f 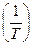 с угловым коэффициентом tg
с угловым коэффициентом tg 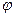 = -
= - 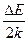 . Отсюда
. Отсюда
Δ E = - 2k tg 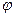 ,
,
где 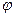 - угол между прямой и положительным направлением оси 1/Т.
- угол между прямой и положительным направлением оси 1/Т.
Так как этот угол всегда тупой, то tg 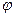 < 0, а ΔЕ > 0. Здесь Δ Е называют термической шириной запрещенной зоны, т. е. вычисленной из температурного хода проводимости.
< 0, а ΔЕ > 0. Здесь Δ Е называют термической шириной запрещенной зоны, т. е. вычисленной из температурного хода проводимости.
Возникновение пары электрон - дырка за счет нарушения нормально заполненной связи (НЗ) можно записать в виде уравнения обратимой реакции НЗ + Δ Е 
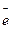 +
+  (где
(где 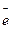 - электрон проводимости,
- электрон проводимости,  - дырка). При заданной температуре устанавливается динамическое равновесие. Процесс, идущий слева направо, является генерацией электронов и дырок, а обратный процесс называется рекомбинацией электронов и дырок. При повышении температуры в соответствии с принципом Ле Шателье это равновесие сдвигается вправо. При данной температуре по закону действия масс можно записать константу равновесия так: K = np / [НЗ]. Из того, что практически очень большая величина [НЗ] постоянна, следует
- дырка). При заданной температуре устанавливается динамическое равновесие. Процесс, идущий слева направо, является генерацией электронов и дырок, а обратный процесс называется рекомбинацией электронов и дырок. При повышении температуры в соответствии с принципом Ле Шателье это равновесие сдвигается вправо. При данной температуре по закону действия масс можно записать константу равновесия так: K = np / [НЗ]. Из того, что практически очень большая величина [НЗ] постоянна, следует
np = const
Нормально заполненных связей практически столько, сколько связей в 1 см3. Например, в 1 см3 германия связей (6,02 ∙ 1023 ∙ 5,32 / 72,59) x 2 = 9,0 ∙ 1022 (здесь 5,32 - плотность германия, г/см3; 72,59 - его атомная масса). Дробь, представляющая собой число атомов германия в 1 см3, умножается на 2 потому, что каждый атом имеет 4 связи с соседними атомами, но каждая связь соединяет два атома.
Для беспримесного полупроводника n = p = ni (ni - от слова intrinsic - собственный); поэтому можно представить
np = n  .
.
Это значит: произведение концентраций электронов проводимости и дырок в полупроводнике при постоянной температуре постоянное, равное произведению концентраций их в собственном полупроводнике при той же температуре и не зависит от характера и количества содержащихся в нем примесей. (Сравните эти закономерности с законами равновесия между ионами Н+ и ОН- в воде и водных растворах.)
Для германия при 3000 К np = 6,25 ∙ 1026. Отсюда концентрация электронов и дырок в беспримесном германии n = p = ni = 2,5 ∙ 1013 см-3. Для кремния ni примерно на три порядка меньше.
Примесные полупроводники. Кроме электронов и дырок, появляющихся одновременно при нарушении валентных связей в собственном полупроводнике, могут быть также и носители зарядов, происхождение которых связано с наличием атомов примесей. В настоящее время удается изготовить полупроводники очень высокой чистоты с концентрацией примесей порядка 10-10 ат. %, однако идеально беспримесных полупроводников вообще нет.
Наиболее чистые образцы германия имеют удельную электропроводность порядка 0,01 - 0,02 ом-1 см-1. Примеси, вводимые в высокоочищенные образцы полупроводников, сильно увеличивают электропроводность, а значит, уменьшают удельное сопротивление. Например, при введении примерно 1015 атомов сурьмы в 1 см3 особо чистого германия (4 ∙ 10-6 вес. %) с удельной проводимостью 0,017 ом-1 ∙ см-1 последняя увеличивается примерно на порядок, а сопротивление падает с 60 до 4 - 10 ом ∙ см. Полупроводники, содержащие примеси (реальные полупроводники), называются примесными. Примеси в полупроводниках принято делить на донорные и акцепторные. Первые создают электронную проводимость, а вторые - дырочную.
Рассмотрим примеры влияния на проводимость германия и кремния примесей замещения. Если в кристаллическую решетку их ввести атом сурьмы или другого элемента V группы, то он, став на место атома германия (или кремния) в узле решетки, образует валентные связи с четырьмя соседними ато-
мами германия, расположенными по вершинам окружающего его тетраэдра. Так как у элементов V группы во внешней оболочке 5 валентных электронов, то один из них будет избыточным и не примет участие в образовании связей. Такой электрон оказывается слабо связанным со своим атомом в кристалле; чтобы его отделить от атома и перевести в междоузлие, нужно затратить мало энергии. В зонной модели это значит, что для перевода такого электрона в зону проводимости необходимо затратить гораздо меньше энергии, чем для перевода электрона с потолка валентной зоны до нижнего края зоны проводимости Δ Е. Значит, уровни, на которых будут находиться такие электроны, должны располагаться в запрещенной зоне вблизи от дна зоны проводимости (на уровне ЕД на рис. 77, б).
Уже при невысокой температуре эти электроны получают достаточное количество энергии (Δ ЕД) - порядка сотых долей электрон - вольта для перехода в зону проводимости. Но это не
оставит дырки в валентной зоне, зато у атома сурьмы появится единичный положительный заряд (неподвижный). Δ ЕД можно назвать энергией активации донорной примеси. Увеличив концентрацию сурьмы в германии, мы тем самым увеличим концентрацию свободных электронов и положительных ионов сурьмы, не увеличив концентрацию дырок. Наоборот, по концентрация дырок должна уменьшаться во столько раз, во сколько увеличивается концентрация электронов n. В этом случае электроны станут основными носителями заряда, а дырки – не основными. Такие полупроводники по преимуществу с электронной проводимостью называются полупроводниками n- типа (от лат. negative - отрицательный).
Если вводить в кристаллическую решетку германия (кремния) атом галлия или другого элемента Ш А подгруппы, то у атома замещающей примеси не хватит одного электрона для осуществления четырех нормальных связей с соседними атомами германия. Одна из связей будет незаполненной (одноэлектронной), но атом галлия и смежный с ним атом германия
будут электронейтральными. Однако при небольшом возбуждении электрон из какой-либо нормальной соседней связи между атомами германия может перейти в место незаполненной
связи. Тогда у атома галлия появится отрицательный заряд,

Рис. 77. Модель образования электронной примесной
проводимости в кремнии и германии:
а - в плоском изображении; б - в зонной энергетической диаграмме; ЕД - донорный уровень; Δ ЕД - энергия активации донора; 1+ - заряд иона донора (остальные обозначения те же, что и на рис. 76)
а где-то вблизи возникнет дырка (рис. 78). Таким легированием германия (кремния) элементами III A подгруппы можно повышать концентрацию дырок, которые станут основными носителями подвижных зарядов, а электроны – не основными. Так как энергия возникновения дырки вблизи акцепторной примеси Δ Еа тоже порядка сотых долей Эв, то появление галлия в решетке германия как примеси замещения, по - видимому, приводит к появлению локального уровня Еа вблизи верхнего края валентной зоны (рис. 78, 6). Уже при невысокой температуре электроны из валентной зоны переходят на этот акцепторный уровень Еа, оставляя дырку в валентной зоне. Полупроводники с избытком дырок (с акцепторными примесями) называются дырочными или р- типа полупроводниками (от лат. positive - положительный).
Атомы замещающей примеси в кристаллах германия и кремния действуют как донорные примеси, если у них валентных электронов больше четырех, и как акцепторные примеси,
если валентных электронов в атомах замещающих примесей меньше четырех. Например, атомы цинка, замещающие атомы кремния в решетке, действуют как двойные акцепторы.
Если примесные атомы образуют твердые растворы внедрения в полупроводнике, то атомы металлов играют роль доноров, а атомы неметаллов - роль акцепторов. Очень важно различать, в какое положение попадают атомы примеси в решетку. Например, при малой концентрации магния в решетке GaAs (ниже 1018 см-3) они действуют как доноры, являясь атомами внедрения, а при большой концентрации начинают действовать как акцепторы, так как становятся заместителями атомов галлия в решетке. Атомы лития и меди, как примеси
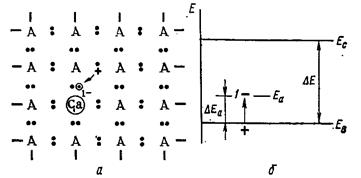
Рис. 78. Модель образования дырочной примесной
проводимости в кремнии или в германии:
а - в плоском изображении; б - в зонной энергетической диаграмме; Еа - акцепторный уровень; Δ Еа - энергия активации акцептора; 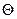 - электрон перекочевавший из места валентной связи между атомами А и оставивший там дырку (+);
- электрон перекочевавший из места валентной связи между атомами А и оставивший там дырку (+);
1- - заряд иона акцептора (остальные обозначения те же,
2- что и на рис. 76)
внедрения в германий, являются донорами. Так же ведет себя медь в арсениде индия.
В полупроводниковых соединениях чем больше будет разность электроотрицательностей атомов в решетке, тем больше степень ионности связей. Это оказывает определенное влияние на свойства полупроводника, так как с увеличением степени ионности связей обычно увеличивается ширина запрещенной зоны.
В случае замещения более электроотрицательного атома полупроводникового соединения атомами с большим числом валентных электронов, чем у замещаемого атома (например, атомов мышьяка в GaAs атомами селена или теллура), примеси являются донорами, а поэтому возникает n- проводимость. Если же примесные атомы имеют меньшее число валентных электронов, то они являются акцепторами, и поэтому появляется р- тип проводимости. То же правило доминирует и при замещении менее электроотрицательного атома другими. Например, при замещении Ga в GaAs атомами Zn, Cd, Mg возникают акцепторные центры и р- тип проводимости. Однако из этих правил есть и исключения, которые пока не нашли себе объяснения. Требуется дальнейшее изучение этих вопросов.
При сильно выраженном ионном характере связи возможно иное объяснение появлению донорных и акцепторных центров в случае образования твердых растворов замещения. Например, если в сульфидах цинка, кадмия, свинца атомы серы замещать атомами хлора, то можно думать, что донорные уровни возникают не потому, что хлор отдает один из своих электронов в зону проводимости, а потому, что сера способна отнимать два электрона от атома металла, а хлор только один. В результате часть электронов, отданная атомами металла, но не присоединенная к атомам хлора, и создает n- проводимость.
Локальные уровни в запрещенной зоне полупроводника могут появиться не только из-за примесей, но и в результате
образования в решетке протяженных дефектов. Например, при
образовании дислокаций в кристаллах германия и кремния создаются акцепторные уровни вследствие того, что ненасыщенные валентные связи около таких дефектов могут захватывать электроны, т. е. играть роль акцепторных центров. Например, в германии дислокации образуют акцепторные уровни, отстоящие примерно на 0,2 эв от дна зоны проводимости. Нарушение стехиометрического состава соединений из-за образования вакансий в различных подрешетках полупроводникового соединения также приводит к появлению донорных или акцепторных центров. При появлении вакансий в подрешетке неметаллических атомов возникают донорные уровни и n- тип проводимости (ZnO1 - x, CdS1 - x, PbS1 - x и т. п.). При появлении вакансий в подрешетке металлических атомов возникают акцепторные уровни и р- тип проводимости (Сu2 - xО, Ti1 - xО, Pb1 - xS и т.п.).
Это правило находит себе объяснение в том, что при удалении атома неметалла из решетки остаются слабо связанные электроны у атомов металла, окружающих пустой узел. Эти электроны легко отделяются от атомов металла и становятся электронами проводимости. При удалении атома металла из решетки у атомов неметалла, окружающих пустой узел, остаются ненасыщенные валентности, которые обусловливают появление акцепторных уровней и порождают р- тип проводимости.
Халькогениды свинца интересны тем, что используются в виде тонких пленок в качестве фотосопротивлений, очень чувствительных к инфракрасным лучам. Все три халькогенида имеют структуру типа NaCl и являются двусторонними фазами вычитания переменного состава. Бребрик и Сканлон изменяли состав кристаллов сульфида свинца, нагревая их 20 ч до 500 0С при разном давлении паров серы, затем быстро охлаждали их до комнатной температуры. На рис. 79 приведены результаты исследования удельного сопротивления полученных образцов,
измеренного при комнатной температуре. Максимум сопро-
тивления получившегося образца отвечает давлению паров серы примерно 0,01 мм рт. ст. (это давление насыщенных паров серы при температуре около 103° С). В этих условиях совершается термодинамическое превращение n- типа сульфида в р- тип и обратно и получается образец с минимумом проводимости, отвечающий стехиометрическому составу PbS. Если упругость паров серы меньше, то во время термической обработки сульфида при 500° С образец приобретает все большую и большую n- проводимость, обусловленную увеличивающейся концентрацией вакансий в подрешетке серы. При увеличивающейся упругости паров серы во время термической обработки сульфид
Дата добавления: 2016-12-09; просмотров: 3530;











