Коррозия и защита материалов от коррозии
Коррозией (лат. corrodere – разъедать, разрушать) называют разрушение материалов под влиянием окружающей среды в результате ее химического или электрохимического воздействия [1].
Обычно рассматривают коррозию металлических материалов. Однако это явление характерно не только для металлов и сплавов, аналогичные процессы могут происходить и в неметаллических материалах – пластмассах, керамике. Примером такого коррозионного воздействия может служить износ футеровки плавильных печей под действием жидкого, химически активного шлака.
Ущерб, причиняемый коррозией, может быть прямым и косвенным. Прямой ущерб включает стоимость замены подвергшихся коррозии частей машин, трубопроводов, устройств. Для восстановления пораженных коррозией оборудования и конструкций ежегодно расходуется не менее 10 % продукции мирового металлургического производства.
Косвенный ущерб от коррозии связан с простоем оборудования в результате аварий, ухудшением качества продукции,например в результате ее загрязнения, увеличением расхода топлива, материалов, энергии. Так, при выходе из строя химической аппаратуры не выпускается продукция, отказ в работе двигателей приводит к простою ценного оборудования, нарушение герметичности газо- и нефтепроводов делает возможной утечку ценного сырья. Если в результате коррозии водопроводной системы прекращается подача воды на металлургический завод, то ремонт водопровода будет стоить во много раз меньше, чем расходы, связанные с остановкой завода на несколько часов. В зависимости от страны и климатических условий суммарный ущерб, наносимый коррозией, достигает уровня 3 – 10% валового продукта[2].
Проникновение в результате коррозии газа, нефти и других продуктов в окружающую среду приводит не только к материальным потерям, но и к угрозе жизнеобеспечению человека и природы. Если ущерб от замены и ремонта оборудования можно хотя бы рассчитать, то ущерб окружающей среде не поддается расчету [5]..
Отличительной особенностью коррозионных процессов является их сложность и многостадийность. Обычно коррозионный процесс состоит по меньшей мере из трех основных стадий:
-переноса реагирующих веществ к поверхности раздела фаз - к реакционной зоне;
-гетерогенной реакции;
-отвода продуктов реакции из реакционной зоны
Установившаяся суммарная скорость коррозионного процесса определяется движущей силой процесса (числителем уравнения 1.1) и торможением протекания его отдельных стадий (знаменатель уравнения 12.1).
Vкоррозии =движущая сила процесса (ДСП) /торможение процесса (ТП) 12.1
Если заторможенность одной из последовательных стадий процесса значительно больше других ( Т2>>Т1 и Т3 ), то суммарная скорость процесса определяется в основном скоростью этой заторможенной стадии (рисунок 12.1(а), стадия 2). Если коррозионный процесс состоит из ряда одновременно протекающих параллельных стадий ( рисунок 12.1(б)), и заторможенность одной из них значительно меньше других ( Т1<<Т2 и Т3), то суммарная скорость процесса определится в основном скоростью этой самой быстрой стадией (рисунок 12.1(б), стадия 1). Если же торможение отдельных стадий сравнимы между собой, то суммарная скорость процесса определяется протеканием этих стадий [3].
Вполне определенные конечные скорости, с которыми протекают термодинамически возможные коррозионные процессы, обуславливаются следующими факторами:
-медленностью диффузии реагентов к поверхности металлов или продуктов реакции в обратном направлении (диффузионный контроль процесса);
-медленностью химической или электрохимической реакции (определяющейся их энергией активации) взаимодействия металла с коррозионной средой или ее компонентами (кинетический контроль процесса);
-медленностью обеих стадий при соизмеримости их торможений (диффузионно-кинетический контроль процесса).
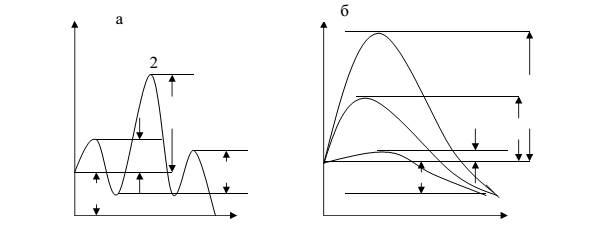
Рисунок 12.1 - Схема протекания коррозионного процесса, состоящего из трех стадий:
а – последовательные стадии; б – параллельные стадии
Оценка коррозионной стойкости металлов. Показатели коррозии
Коррозионные испытания позволяют определить влияние различных факторов (физико-химических, технологических, эксплутационных) на скорость коррозии металлов, т.е. определить его коррозионную стойкость. Скорость коррозии зависит от множества одновременно действующих факторов, среди которых как внутренние, характеризующие природу материала, его технологию, состав и тип структуры, состояние поверхности, так и внешние, характеризующие состав агрессивной среды и условия протекания процесса (давление, темпе-
ратура, гидродинамические условия и др.). Её можно выражать различными способами.
а)Наиболее часто употребляемые показатели: а) массовый показатель (Кмасс) скорости коррозии представляет собой потерю массы (∆m) в единицу времени (t), отнессенную к единице поверхности (S) испытуемого образца:
(Кмасс)= ∆m / t • S =( mн - mк) /t • S (12.2)
где mн и mк - соответственно начальная и конечная масса образца. Чаще его выражают в г/(м 2 сут).
б) Глубинный показатель (П) скорости коррозии характеризует среднюю глубину (h) разрушения
металла в единицу времени:
П= h/t (12.3)
В справочной литературе его выражают в мм/год. Глубина разрушения может быть определена через потерю массы металла, его плотность (ρ) и площадь:
h= ∆V/S= ∆m / ρ• S (12.4)
где ∆V - уменьшение объема образца в результате коррозии.
Объединяя выражения (1.2.1), (1.2.2) и (1.2.3), получаем соотношение, устанавливающее связь между массовым и линейным показателями скорости коррозии:
П = 365 Кмасс / ρ (12.5)
где р - выражено в кг/м3 ; Кмасс - в г/(м сут); П - в мм/год ; 365 - число дней в году.
в)Объемный показатель (Коб.) скорости коррозии используется реже. Он равен объему (V) поглощаемого или выделяемого при коррозии газа (чаще всего О2 или Н2), отнесенному к единице поверхности металла и единице времени:
Коб = М//t • S (12.6)
г)Плотность коррозионного тока (iкорр.) используется для характеристики скорости только электрохимической коррозии:
iкорр.= Кмасс • Z/24M•26,8• 10 -4 [ А/м2 ] (12.7)
где М - молярная масса металла; Z - заряд иона или число электронов, отдаваемых металлом при его окислении; 26,8 х10-4 - постоянная Фарадея, (Ахч)/моль•хэкв; 24 - число часов в сутки.
д) По доле поверхности, занятой продуктами коррозии;
е) По количеству коррозионных язв или точек на поверхности;
ж) По объему, выделившегося с единицы поверхности Н2 или поглощенного О2;
з) По времени появления первого очага коррозии;
и) По времени появления коррозионной трещины или полного разрушения образца;
к) По величине тела коррозии.
Косвенные показатели.
а) по изменению физико-механических свойств: времени сопоставления растяжению, сжатию, изгибу;
б) по изменению электрического сопротивления [11].
Вышеприведенные показатели скорости коррозии используются, как правило, для оценки равномерной коррозии. Так, по величине глубинного показателя (П) все металлы, согласно ГОСТ 13819-68 подразделяются на группы коррозионной стойкости. В зависимости от свойств окружающей среды и характера ее физико-химического воздействия на материал различают:
1) химическую коррозию, обусловленную воздействием сухих газов, а также жидкостей, не являющихся электролитами (нефть, бензин, фенол);
2) электрохимическую коррозию, обусловленную воздействием жидких электролитов: водных растворов солей, кислот, щелочей, влажного воздуха, грунтовых вод, т. е. растворов, содержащих ионы и являющихся проводниками электричества.
3)микробиологическая коррозия - это коррозионное разрушение металлов при воздействии микроорганизмов и продуктов их жизнедеятельности. Часто инициирование электрохимической коррозии металлов вызвано микроорганизмами. Бактерии могут вырабатывать серную, муравьиную, уксусную и другие карбоновые кислоты, деполяризовать катодные участки коррозионных микрогальванических элементов, окислять ионы металлов и ассимилировать электроны с поверхности металлов. Биоповреждениям подвержены металлические поверхности, пластмассы, смазки[11].
По условиям протекания коррозии, которые весьма разнообразны, различают следующие виды коррозии:
-газовую коррозию - коррозию металлов в газах при высоких температурах (например, окисление и обезуглероживание стали при нагревании);
-атмосферную - коррозию металлов в атмосфере воздуха, а также любого влажного газа (например, ржавление стальных конструкций в цехе или на открытом воздухе);
-жидкостную коррозию - коррозию металлов в жидкой среде в неэлектролите (бром, расплавленная сера, органический растворитель, жидкое топливо) и в электролите (кислотная, щелочная, солевая, морская, речная коррозия, коррозия в расплавленных солях и щелочах). В зависимости от условий взаимодействия среды с металлом различают жидкостную коррозию металла при полном, неполном и переменном погружении; коррозию в неперемешиваемой (спокойной) и перемешиваемой (движущейся) коррозионной среде;
-подземную коррозию - коррозию металлов в почвах и грунтах (например, ржавление подземных стальных трубопроводов);
-структурную коррозию, связанную со структурной неоднородностью металла (например, ускорение коррозионного процесса в растворах H2SO4 и HCl катодными включениями: карбидами в стали, графитом в чугуне, интерметаллидом CuAl2 в дюралюминии);
-биокоррозию - коррозию металлов под влиянием жизнедеятельности микроорганизмов (например, усиление коррозии стали в грунтах сульфат - редукционными бактериями);
коррозию внешним током - электрохимическую коррозию металлов под воздействием тока от внешнего источника (например, растворение стального анодного заземления станции катодной защиты подземного трубопровода);
-коррозию блуждающим током - электрохимическую коррозию металла (например, подземного трубопровода) под воздействием блуждающего тока;
-контактную коррозию - электрохимическую коррозию, вызванную контактом металлов, имеющих разные стационарные потенциалы в данном электролите (например, коррозия в морской воде деталей из алюминиевых сплавов, находящихся в контакте с медными деталями);
-щелевую коррозию - усиление коррозии в щелях и зазорах между металлами (например, в резьбовых и фланцевых соединениях стальных конструкций, находящихся в воде);
-коррозию под напряжением - коррозию металлов при одновременном воздействии коррозионной среды и механических напряжений;
-коррозионную кавитацию - разрушение металла, вызванное одновременно коррозионным и ударным воздействием внешней среды;
-коррозию при трении (коррозионная эрозия) - разрушение металла, вызываемое одновременным воздействием коррозионной среды и трения;
-фреттинг-коррозию - коррозию металлов при колебательном перемещении двух поверхностей относительно друг друга в условиях воздействия коррозионной среды[15].
По характеру коррозионного разрушения различают следующие виды коррозии:
1) сплошную или общую коррозию, охватывающую всю поверхность металла, находящуюся под воздействием данной коррозионной среды. Сплошная коррозия бывает:
а) равномерной, которая протекает с одинаковой скоростью по всей поверхности металла (направленная коррозия в углеродистой стали в растворах H2SO4);
б) неравномерной, которая протекает с неодинаковой скоростью на различных участках поверхности металла (направленная коррозия углеродистой стали в морской воде);
в) избирательной, при которой разрушается одна структурная составляющая сплава (графитизация чугуна) или один компонент сплава (обесцинкование латуней).
Местную коррозию, охватывающую отдельные участки поверхности металла. Местная коррозия бывает:
а) пятнами - в виде отдельных пятен (например коррозия латуни в морской воде);
б) язвами - коррозионное разрушение, имеющее вид раковины (например, коррозия стали в грунте);
в)точечной (питтинг) - в виде отдельных точечных поражений (например, коррозия аустенитной хромоникелиевой стали в морской воде);
г) сквозной, которая вызывает разрушение металла насквозь;
д) нитевидной, распространяющейся в виде нитей преимущественно под неметаллическими защитными покрытиями (например, на углеродистой стали под пленкой лака);
е) подповерхностной, начинающейся с поверхности, но преимущественно распространяющейся под поверхностью металла таким образом, что разрушение и продукты коррозии оказываются сосредоточенными в некоторых областях внутри металла; подповерхностная коррозия часто вызывает вспучивание металла и его растрескивание (например, образование пузырей на поверхности недоброкачественно прокатанного листового металла при коррозии и травлении);
ж) межкристаллитной, распространяющейся по границам кристаллитов (зерен) металла (например, коррозия в некоторых условиях хромоникелиевой стали, после ее замедленного охлаждения или нагрева);
з) ножевой - локализованная коррозия металла, имеющая вид надреза ножом в зоне сплавления сварных соединений в сильно агрессивных средах;
и) коррозионным растрескиванием - коррозия металла при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений растяжения с образованием транс- кристаллитных или межкристаллитных трещин;
к) коррозионной хрупкостью, приобретенной металлом в результате коррозии (например, водородное охрупчивание труб из высокопрочных сталей в условиях сероводородных нефтяных скважин) [11].
Наиболее распространенным видом химической коррозии является газовая коррозия при высоких температурах – процесс взаимодействия с кислородом или активными газовыми средами (галогены, диоксид серы, сероводород, пары серы, диоксид углерода и т. д.). При газовой коррозии разрушаются такие ответственные узлы и детали, как лопатки газовых турбин, сопла реактивных двигателей, арматура печей.
В производственных условиях чаще всего сталкиваются с окислением металлов, в случае сплавов на основе железа – с образованием окалины. Защитные свойства металлов от окисления обусловлены образованием сплошных оксидных пленок на их поверхности. Для обеспечения сплошности пленок необходимо, чтобы объем оксида Vок был больше объема металла Vмет, из которого он образовался: Vок/Vмет > 1. В противном случае получается прерывистая пленка, не способная эффективно защитить металл от коррозии. Такая пленка характерна для магния (Vок/Vмет = 0,79), что затрудняет защиту сплавов на его основе от коррозии.
Помимо сплошности оксидные пленки должны обладать высокими механическими свойствами, иметь хорошее сцепление с металлом и достаточную толщину, обеспечивающую высокие защитные характеристики. Этим требованиям удовлетворяет пленка оксида хрома Сr2О3, что обусловливает высокую устойчивость против коррозии сталей и жаростойких сплавов с высоким содержанием хрома[16].
Электрохимическая коррозия – наиболее распространенный вид коррозии металлов. При электрическом контакте двух металлов или двух различающихся по свойствам фазовых составляющих одного металла, которые обладают разными электродными (электрохимическими) потенциалами, но находятся в одном электролите, образуется гальванический элемент. Поведение металлов или отдельных фаз зависит от значения их электродного потенциала. Металл или фаза, имеющие более отрицательный электродный потенциал (анод), отдают положительно заряженные ионы в раствор и растворяются (рисунок 12.2). Избыточные электроны перетекают в металл или фазу, имеющие более высокий электродный потенциал (катод). Катод при этом не разрушается, а электроны из него удаляются во внешнюю среду. Чем ниже электродный потенциал металла или фазы по отношению к стандартному водородному потенциалу, принятому за нулевой уровень, тем легче металл или фаза отдают ионы в раствор, тем ниже их коррозионная стойкость.
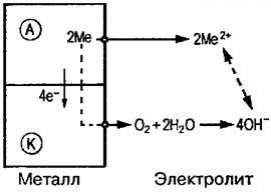
Рисунок 12.2. – Схема электрохимического коррозионного процесса
Значения электродного потенциала Ео некоторых металлов приведены ниже:
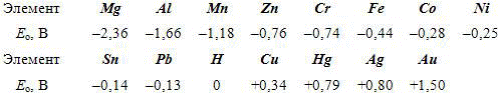
Ход электрохимического процесса определяется разностью потенциалов элементов, который, например, для пары Сu – Zn разность потенциалов составляет 1,1В.
В случае замкнутой цепи медь является катодом, а цинк – анодом, что приводит к его растворению. Если приложить напряжение более 1,1 В, то анод и катод поменяются местами, что приведет к растворению меди и восстановлению металлического цинка.
В зависимости от коррозионной среды различают два вида электрохимической коррозии – с водородной и кислородной деполяризацией.
Коррозия с водородной деполяризацией характерна для разрушения металлов в кислотной среде. Примером может служить та же пара Cu – Zn, находящаяся в растворе H2SO4 (рисунок 12.3).
Благодаря отрицательному потенциалу цинк разрушается и в раствор переходят положительные ионы цинка.
Вследствие полярного строения молекул воды происходит гидратация ионов
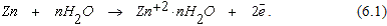 (12.8)
(12.8)
Освобождающиеся электроны движутся по внешней цепи от анода к катоду
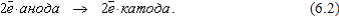 (12.9)
(12.9)
Вблизи катода имеются положительные ионы водорода Н+, образовавшиеся в результате диссоциации серной кислоты
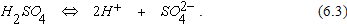 (12.10)
(12.10)
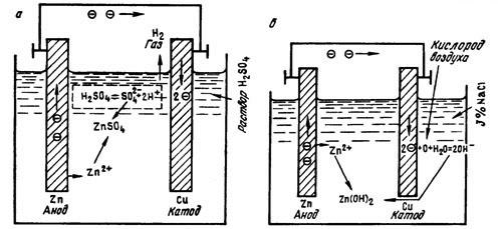
Рисунок 12.3 – Схемы процессов, протекающих в гальваническом элементе: а – водородная деполяризация; б – кислородная деполяризация
Ионы водорода, соединяясь с подошедшими к катоду электронами, образуют молекулы водорода, пузырьками выделяющегося с поверхности катода
 (12.11)
(12.11)
Ионы водорода выступают в роли деполяризаторов. Они отводят электроны с катода и способствуют восстановлению его потенциала.
Продуктом коррозии является сульфат цинка, образовавшийся в результате соединения ионов SO42- с перешедшими в раствор ионами Zn2+
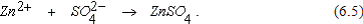 (12.12)
(12.12)
При кислородной деполяризации электроны отводятся кислородом, растворенным в электролите и попадающим туда из воздуха. Примером может служить коррозия цинка в контакте с медью в водном растворе какой-либо соли, например NaCl, водимой для увеличения электропроводности среды.
Электроны отводятся с катода путем взаимодействия с кислородом и водой по схеме
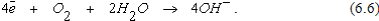 (12.13)
(12.13)
Возможна схема с образованием пероксида водорода
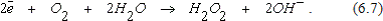 (12.14)
(12.14)
В обоих случаях деполяризатором является кислород. От подвода кислорода к аноду зависит скорость всего коррозионного процесса.
Образующиеся гидроксильные ионы, соединяясь с ионами цинка, образуют Zn(OH)2 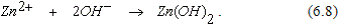 (12.15)
(12.15)
Анализ работы гальванических элементов позволяет заключить, что при коррозии всегда разрушается анод из металла с меньшим электродным потенциалом. Катод не разрушается и является электродом, на котором осуществляются процессы деполяризации.
Виды электрохимической коррозии
Приведенная схема работы гальванической пары лежит в основе электрохимической коррозии металлов и сплавов. Разные фазовые составляющие, присутствующие в структуре сплава, находясь в электролите, приобретают разные по величине и знаку электродные потенциалы. Чем больше различие в электродных потенциалах отдельных фазовых составляющих, тем активнее будет протекать коррозионный процесс и коррозионное разрушение сплава. Электрохимическая гетерогенность поверхности металла является причиной коррозии. Более коррозионностойкими являются сплавы со структурой однородного твердого раствора.
Однако даже в случае однородной структуры коррозия может развиваться за счет образования анодных областей из-за наличия межкристаллитной пористости, различия остаточных напряжений в отдельных зернах и других факторов.
Особенно сильно электрохимическая коррозия развивается в случае контакта в конструкции разнородных материалов с разными потенциалами (например, коррозия стальных деталей в контакте с медными или магниевых сплавов в контакте со сталью).
Иллюстрацией могут служить две стальные пластинки, одна из которых покрыта оловом, а другая цинком. Нарушение этих пленок приводит к тому, что из-за разности электродных потенциалов железо в пластинке с оловом становится анодом, и подвергается коррозионному разрушению. В пластинке с цинком сталь становится катодом. Цинк, разрушаясь, защищает железо от коррозии. Этим объясняется долговечность строительной жести, домашних ведер, оцинкованных кузовных листов и др.
Схемы основных разновидностей электрохимической коррозии приведены на рисунке 12.4.
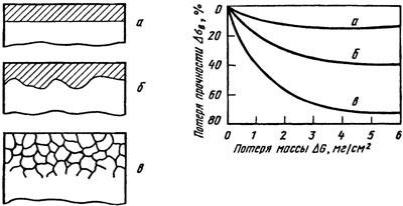
Рисунок 12.4. – Основные разновидности электрохимической коррозии (схема) и их относительное влияние на прочность листового дюралюмина: а – равномерная коррозия; б – местная коррозия; в – межкристаллитная коррозия
В случае однофазного материала, например чистого металла или однородного твердого раствора, коррозия распространяется равномерно по всей поверхности детали – происходит так называемая общая или равномерная коррозия (рисунок 6.3, а). Обработка, ведущая к гомогенизации структуры, делает сплав более устойчивым против электрохимической коррозии. Примером такой обработки является закалка хромоникелевой коррозионностойкой стали или отжиг оловянистых бронз, имеющих после литья неоднородное строение вследствие ликвации. Наоборот, нагрев сплавов, приводящий к распаду пересыщенного твердого раствора и выделению частиц второй фазы, снижает коррозионную стойкость. Разность потенциалов отдельных составляющих микроструктуры способствует электрохимической коррозии.
В неоднородных металлах коррозия носит местный характер, охватывая отдельные анодные участки их поверхности с низким значением электродного потенциала (рисунок 12.4, б). К местной коррозии относятся питтинг или точечная коррозия, а также пятнистая и язвенная ее разновидности. Очаги местной коррозии являются концентраторами напряжений.
Анодными участками могут быть границы зерен и фаз, в то время как зерна сами по себе являются катодами. В этом случае развивается наиболее опасный вид коррозии – межкристаллитная коррозия (МКК). Она почти незаметна с поверхности и распространяется в глубь металла по границам зерен (рисунок 12.4, в). В результате межкристаллитной коррозии нарушается связь между зернами, при постукивании по металлу пропадает характерный металлический звук, и после приложения нагрузки металл легко разрушается.
Межкристаллитная коррозия высокохромистой стали обусловлена выделением при повышенных температурах по границам зерен карбидов типа Сr23С6. Эти карбиды образуются в результате диффузии углерода из всего объема зерна, а хрома – только с приграничных областей. Углерод перемещается по межузельному механизму диффузии (по механизму внедрения), который по сравнению с перемещением атомов по механизму замещения характеризуется высокой подвижностью. Это приводит к снижению содержания хрома в приграничных областях ниже его критической концентрации 12 – 14 % и скачкообразному падению электродного потенциала с +0,2 до –0,6 В. Границы зерен становятся анодом по отношению к металлу внутри зерен.
Эффективным средством, подавляющим межкристаллитную коррозию, является максимальное снижение содержания углерода и введение в сталь таких сильных карбидообразующих элементов, как титан или ниобий, обладающих большим сродством к углероду, чем хром.
При одновременном действии коррозионной среды и нагрузки или остаточных напряжений возникает коррозия под напряжением, проявляющаяся в виде коррозионного растрескивания или сетки трещин. Места концентрации напряжений имеют более низкий электродный потенциал и приобретают характер анодных участков.
Из повседневной жизни известно, что в поврежденных местах кузовов автомобилей, а также в местах деформаций листового металла продукты коррозии появляются чаще всего. Высокие остаточные напряжения являются причиной ускоренной коррозии сварных швов, околошовной зоны, болтовых, заклепочных и других соединений.
Большое влияние на процесс коррозии в водных средах оказывает растворенный в жидкости кислород. При достаточном содержании кислорода на поверхности образуется защитная оксидная пленка, повышающая электродный потенциал металла. Наиболее опасные анодные зоны создаются в местах плохой аэрации, где затруднен доступ кислорода из воздуха. Хорошо известно, что та часть стальной плиты, которая находилась под слоем песка, корродирует в большей степени по сравнению с той частью, которая оставалась под непосредственным влиянием атмосферы. Стальные гвозди в старых деревянных конструкциях разрушаются гораздо быстрее, чем их головки, расположенные снаружи. Аналогичное явление наблюдается в щелях замкнутых профилей (пример – пороги автомобилей), на стыке листов, на резьбовой поверхности в болтовых соединениях, на грязной поверхности и т. д. Примеры таких случаев представлены на рисунке 12.5, а в таблице 12.1 представлены некоторые группы коррозионных пар.
Внутренние напряжения сами по себе трудно обвинить в появлении коррозии. Интенсифицируя это явление, они становятся инициаторами анодного процесса. Неоднородность внутренней структуры материала способствует коррозии. Коррозионные явления усиливаются при наложении анодной напряженности на структурную[17].
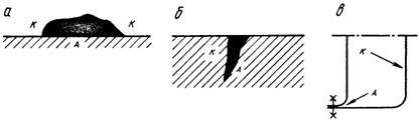
Рисунок 12.5 – Коррозионные пары, образовавшиеся при загрязнении поверхности стального листа (а), в устье трещины (б), в щели замкнутого профиля (б)
Состав атмосферы также оказывает влияние на коррозию сплавов. В городах, где воздух згрязнен промышленными газами, коррозия проявляется значительно сильнее, чем в сельской местности. Для стальных деталей особенно вредными являются сернистый газ SO2, сероводород H2S, хлор Сl2 и хлористый водород НСl. Таблица 12.1
| Группа коррозионных пар | Коррозионная пара | Анод | Катод |
| Коррозионные пары из двух различных материалов | Fe-Zn Fe-Sn Fe-H 2 Cu- H 2 Перлит Cu-Al | Zn Fe Fe H 2 Феррит Al | Fe Sn H 2 Cu Цементит Cu |
| Структурные или напряженные коррозионные пары | Границы зерен Мелкие и крупные зерна Дефекты структуры Деформированные детали Напряженные болтовые, сварные, клепанные соединен. | Область с большей внутренней энергией Границы зерен Мелкие зерна Дефекты Зона деформации Напряженные зоны | Область с меньшей внутренней энергией Тело зерна Крупные зерна Структура без дефектов Недеформированная зона Зоны, свободные от напряжений или с меньшими напражениями |
| Концентрационные коррозионные пары | Различная концентрация электролита Разная концентрация кислорода (доступ воздуха) Загрязненная поверхность | Зона с меньшей концентрацией реагента Электролит с меньшей концентрацией Меньшая концентрация кислорода- затруднен доступ воздуха Загрязненные или окисленные области | Зона с большей концентрацией реагента Электролит с большей концентрацией Большая концентрация кислорода- облегчен доступ воздуха Участки чистой поверхности |
Хлористый водород также опасен для алюминиевых и магниевых сплавов. Для медных сплавов характерна повышенная коррозия в атмосфере аммиака NH3.
По повышению коррозионной агрессивности различные виды атмосфер могут быть расположены в следующий ряд: сухая континентальная, морская чистая, морская индустриальная, индустриальная, индустриальная сильно загрязненная.
Коррозионная усталость – это процесс постепенного накопления повреждений материала под действием переменных напряжений и коррозионно-активных сред. Образование и развитие усталостных трещин сопровождается проникновением коррозионной среды в эти трещины и облегчает разрушение. Этому виду разрушения подвержены практически любые конструкционные материалы на основе железа, алюминия, титана, меди и других металлов. Особая опасность коррозионно-усталостного разрушения состоит в том, что оно может проходить практически в любых, в том числе таких слабых коррозионных средах, как влажный воздух, газы, влажные машинные масла и др. Поэтому коррозионная усталость металлов и сплавов наблюдается во всех отраслях техники, прежде всего в энергетической, нефтегазодобывающей, горнорудной промышленности, в морском, наземном и воздушном транспорте.
При коррозиионо-усталостном нагружении разрушение может произойти при напряжениях, значительно меньших обычного предела усталости. При этом величина условного предела усталости приближается к нулевому значению. Объясняется это тем, что даже при минимальных напряжениях или их отсутствии недостаточно защищенный металл разрушится только от коррозии. Прогрессирующий рост трещин усталости обусловлен с одной стороны низким значением электродного потенциала в месте концентрации напряжений, а с другой – легким разрушением защитной оксидной пленки в устье трещины при переменном нагружении.
Коррозионностойкие стали
Устойчивость против коррозии повышается при введении в состав стали хрома, алюминия, кремния. Эти элементы образуют непрерывную прочную оксидную пленку и повышают электродный потенциал, т. е. увеличивают электроположительность стали. Алюминий и кремний повышают хрупкость стали и применяются реже хрома. При содержании хрома более 12 % сталь резко изменяет электродный потенциал с электроотрицательного (–0,6 В) на электроположительный (+0,2 В). На поверхности образуется плотная защитная пленка оксида Сr2О3.
Сталь, содержащая 12 – 14 % Сr, устойчива против коррозии в атмосфере, морской воде, ряде кислот, щелочей и солей. Кроме хрома, в состав коррозионностойких сталей вводят также другие элементы – чаще никель. С ростом содержания хрома коррозионная стойкость стали растет.
Коррозионностойкие стали (corrosion-resistant steel) обычно делят на хромистые ферритные, содержащие 12 – 25 % Сr и 0,07 – 0,2 % С и хромистые мартенситные, содержащие 12 – 18 % Сr и 0,15 – 1,2 % С, а также аустенитные стали, содержащие 12 – 18 % Сr, 8 – 30 % Ni и 0,02 – 0,25 % С.
Хромистые стали коррозионностойки при температуре до 300°С в водопроводной воде, влажной атмосфере, растворах азотной кислоты и многих органических кислотах. В морской воде хромистые стали подвержены коррозионному растрескиванию под напряжением.
Содержание углерода в коррозионностойких аустенитных сталях ограничено, и желательно, чтобы оно было ниже предела растворимости углерода в легированном никелем аустените при 20°С, составляющего 0,04 %. Присутствие в стали более высоких концентраций углерода может приводить к образованию карбидов хрома типа Сr23С6, вследствие чего твердый раствор обедняется хромом и создается двухфазная структура. При этом снижается коррозионная стойкость стали. Для предотвращения образования карбидов хрома, особенно при технологических нагревах, связанных с проведением операций сварки или пайки и опасностью возникновения межкристаллитной коррозии, в сталь вводят дополнительно титан, ниобий или тантал. Эти элементы связывают углерод в карбиды типа TiC, NbC, TaC, оставляя хром в твердом растворе. Необходимое количество титана для введения в сталь определяют по формуле
Ti = (С – 0,02)*5
где С – содержание углерода в стали.
Стали, не склонные к межкристаллитной коррозии, называют стабилизированными. Эффект стабилизации может быть достигнут, помимо введения сильных карбидообразующих элементов, снижением содержания углерода ниже 0,04 %.
Хромоникелевые коррозионностойкие стали содержат дефицитный и дорогостоящий никель и поэтому имеют высокую стоимость. В ряде случаев применяют более дешевые стали, в которых весь никель или часть его заменены марганцем. Например, до температур –196°С и в слабоагрессивных средах вместо стали 12Х18Н10Т может быть использована сталь 10Х14Г14Н4Т.
Азот повышает стабильность аустенита, поэтому для повышения коррозионной стойкости можно использовать более высокие концентрации хрома и молибдена, не увеличивая склонность стали к выделению интерметаллидных фаз. Примером может служить сталь 03Х20Н16АГ6, используемая в криогенной технике.
Коррозионностойкие сплавы цветных металлов
Различают две группы коррозионностойких цветных металлов:
– непассивирующиеся металлы с высоким электродным потенциалом (Аu, Pt, Ag, Сu и сплавы на их основе);
– пассивирующиеся металлы, образующие на поверхности плотные защитные пленки оксидов (Ti, Al, Cr).
Золото, платина, серебро коррозионностойки практически в любых средах, кроме некоторых концентрированных кислот. Медь сохраняет коррозионную стойкость во влажной атмосфере, морской воде и многих органических кислотах. Для подавления склонности латуней к коррозионному растрескиванию во влажной атмосфере проводят отжиг для снятия внутренних напряжений.
Пассивирующиеся металлы характеризуются высокой коррозионной стойкостью в сухой и влажной воздушной среде, в органических и неорганических кислотах. Титан по сопротивлению коррозии уступает только золоту и платине. Высокая коррозионная стойкость титана объясняется образованием на поверхности стойкой пассивирующей пленки оксида TiO2. Он сохраняет коррозионную стойкость даже при нагреве во влажной атмосфере. Титановые сплавы обладают высокой стойкостью против кавитационнои коррозии в морской воде.
Алюминий и алюминиевые сплавы образуют на поверхности защитную оксидную пленку Аl2О3, что обеспечивает их коррозионную стойкость во влажной атмосфере и в кислотной среде. Пленка устойчива в нейтральных средах, но легко растворяется в щелочах. Поэтому в щелочных средах алюминий и его сплавы легко разрушаются. В морской воде алюминиевые сплавы подвержены коррозионному растрескиванию.
Такие легирующие элементы, как медь и железо, имеющие более высокий электродный потенциал, ухудшают коррозионную стойкость алюминиевых сплавов. Дуралюмины, легированные медью, по коррозионной стойкости существенно уступают чистому алюминию. Легирование электроотрицательными элементами кремнием и магнием не ухудшает пассивность, а марганец оказывает даже положительное влияние благодаря образованию соединения (MnFe)Al6, что позволяет удалить железо из твердого раствора и устранить его отрицательное действие на коррозионную стойкость. Поэтому сплавы типа АlMn сопротивляются коррозии даже лучше, чем технический алюминий [5].
Методы защиты от коррозии
Методы защиты от коррозии можно объединить в следующие группы:
1) нанесение защитных покрытий и пленок;
2) изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз;
3) модификация коррозионной среды.
Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом. В качестве защитных применяют металлические и неметаллические покрытия.
Металлические покрытия могут быть выполнены из металла более или менее благородного, чем подложка. В связи с этим они делятся на две группы: катодные и анодные покрытия.
К катодным покрытиям относятся те покрытия, электрохимический потенциал которых в данных условиях больший, чем у защищаемого металла. На алюминий почти всегда наносят катодные покрытия. Покрытия из благородных металлов на стали имеют такой же характер. Катод
| <== предыдущая лекция | | | следующая лекция ==> |
| Композиционные материалы | | | Основные компоненты современного ядерного реактора |
Дата добавления: 2018-05-10; просмотров: 2347;











