Виды элементарных ячеек
Частицами, из которых построены элементарные ячейки, могут быть атомы, молекулы, ионы и атомы металлов, связанные между собой металлической связью. Мы различаем следующие типы кристаллических решеток: атомные, молекулярные, ионные и металлические.
Атомные решетки построены из атомов, связанных между собой ковалентными неполярными связями. Эти химические связи определяют геометрию кристаллов и энергию кристаллической решетки, которая характеризует прочность и устойчивость данного кристалла. Так как строение атома периодично, то, казалось бы, и строение кристаллов тоже должно быть периодичным, но это выполняется не строго, поскольку атомы могут перестраивать свои орбитали при различных степенях возбуждения и таким образом изменять свои химические связи. Это ведет к образованию различных форм кристаллов - полиморфизму или аллотропическим модификациям у данного элемента. У его электронных аналогов, находящихся в разных периодах, возможно возникновение других форм связи за счет наличия другого числа свободных орбиталей.
Координационное число атомной решетки должно зависеть от распределения электронов внешнего уровня и количества валентных орбиталей. Это хорошо учитывает правило Юм-Розери, которое можно представить следующим образом:
K = 8 - N,
где К - координационное число, N - номер группы в периодической системе Д. И. Менделеева. Так, например, кристаллы иода, находящегося в VII группе и имеющего электронную формулу s2p5 по Юм-Розери, должны иметь координационное число, равное 1.
В действительности кристаллы иода состоят из отдельных молекул - I2, связанных между собой межмолекулярными силами. Кристаллы иода очень непрочны и легко при нагревании переходят в пар (сублимация), состоящий из молекул I2. По существу, кристаллы, иода следует отнести к молекулярным кристаллам.
Кристаллы кислорода, которые по правилу 8 - N имеют К = 2, представляют собой цепочечные структуры, а сера, атомы которой имеют свободные орбитали и могут возбуждаться, дает уже две аллотропические формы - моноклиническую и ромбоэдрическую серу, кристаллы которых образованы за счет дополнительных связей. Однако сера имеет и другие кристаллические формы, образованные цепочками из атомов серы, подобно кислородным.
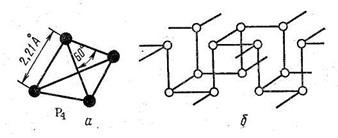
Рис. 34. Кристаллические структуры фосфора
Кристаллы азота с координационным числом 3 (К = 8 - 5) тоже очень непрочные (tплавл = - 209,86 С°), а его электронный аналог фосфор образует или молекулярную решетку из молекул Р4, в которой сохраняется координационное число 3 (рис. 34, а), - белый фосфор, или образует красный фосфор переменной структуры и только при особых условиях (200 °С и 12 000 атм.) образует черный фосфор Бриджмена, также имеющий слоистую структуру с координационным числом 3. Структура черного фосфора показана на рис. 34, б.
Наиболее типичными атомными кристаллами являются кристаллы алмаза. Так кристаллизуется углерод; его атомы находятся в состоянии s1p3 и орбитали их полностью гибридизированы. Координационное число кристалла алмаза 4, что также соответствует правилу Юм-Розери. Кристаллическая решетка алмаза представляет собой центрированный тетраэдр, который можно отнести к кубической системе, так как он вписывается в куб, а макроформа кристаллов алмаза представляет собой модифицированный куб.
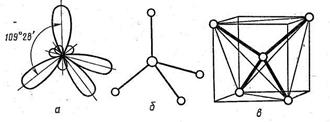
Элементарная ячейка алмаза довольно сложна. Она представляет собой гранецентрированный куб, в который еще дополнительно вписано 4 атома углерода. Число частиц, необходимое для построения такой элементарной ячейки, n = (1/8)
|
|
Рис. 35. Элементарная ячейка алмаза: а - гибридные орбитали; б - тетраэдр; в - тетраэдр вписанный в куб; г - элементарная ячейка алмаза
8 + (1/2) 6 + 4 = 8. Координационное число 4, так как в данном случае оно равно числу гибридных орбиталей атома углерода. Формы гибридных орбиталей, связи между углеродными атомами в кристалле алмаза и элементарная ячейка алмаза приведены на рис. 35, а, б, в, г.
Однако кроме алмаза, обладающего наибольшей твердостью из всех твердых тел (за счет очень малых межатомных расстояний - 1,54 Ǻ), углерод образует кристаллы графита. В его решетку входят тоже возбужденные атомы углерода, но, с
неполностью гибридизированными орбиталями, вследствие чего расстояния между атомами в кристаллической решетке графита (в плоскости и межплоскостном расстоянии) различны и в результате графит оказывается очень мягким, легко скалывающимся по плоскостям спайности. Графит применяется в машинах как высокотемпературная смазка, в то время как алмазные резцы обрабатывают самые твердые материалы.
Неполностью гибридизированный атом углерода и кристаллическая решетка графита приведены на рис. 36.
Кристаллы графита более устойчивы, чем кристаллы алмаза, которые при нагревании около 1000 °С (без доступа воздуха) переходят в графит. Кристаллы графита проводят электрический ток по типуполупроводников 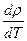 < 0, так как не все связи между атомами углерода строго локализованы и миграция связей создает условия полупроводимости.
< 0, так как не все связи между атомами углерода строго локализованы и миграция связей создает условия полупроводимости.
Третья кристаллическая модификация углерода - карбин - образует гексагональную решетку из цепочек, образованных атомами углерода. Расстояние между атомами углерода в карбине очень мало (1,284 А). Карбин обладает также полупроводниковыми свойствами. Схема цепочки атомов углерода в карбине показана на рис. 37.
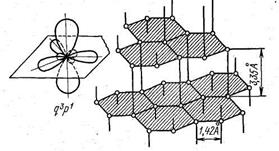
Рис. 36. Кристаллическая структура графита
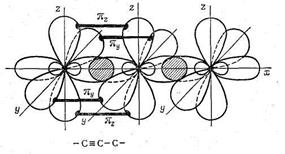
Рис. 37. Цепочная структура кристаллов карбина
Четвертая кристаллическая модификация углерода – фуллерен. Он был экспериментально открыт в 1985 г. и является частицей состоящей из 60 атомов углерода с массой 12 атомных единиц каждый (С60). Схема молекулы показана на рис. 38
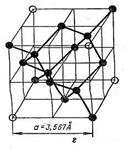
Она имеет 12 пентагональных (пятиугольных) и 20 гексагональных (шестиугольных) симметрично расположенных граней, образующих форму, близкую к шару. На самом деле, геометрия молекулы фуллерена ближе к форме футбольного мяча, также состоящего из пяти- и шестигранных фасеток. Эти шарообразные молекулы могут соединяться друг с другом в твердом теле с образованием гранецентрированной (ГЦК) кристаллической решетки, показанной на рис. 39.
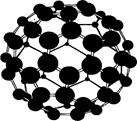
Рис. 38. Структура молекулы фуллерена С60
Рис. 39. Элементарная ячейка кристаллической решетки фуллерена С60 (большие шары), легированного
щелочными атомами (темные кружки)
Расстояние между центрами ближайших молекул в гранецентрированной решетке, удерживаемых слабыми Ван дер Ваальсовыми силами, имеет наноразмеры (около 1 нм). Поскольку С60 растворим в бензоле, его монокристалл можно вырастить при медленном выпаривании раствора С60 в бензоле.
Наиболее интересными наноструктурами с широким потенциалом применения являются углеродные нанотрубки. Углеродную нанотрубку можно представить себе как лист графита, свернутый в цилиндр. На рис. 40 показано несколько возможных структур, образованных сворачиванием графитового листа вокруг разных осей. Однослойная нанотрубка может иметь диаметр 2 нм и длину 100 микрон, что делает ее квазиодномерной структурой, способной служить нанопроволокой.
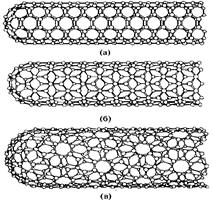
Рис. 40. Примеры некоторых из возможных структур
углеродных нанотрубок, зависящих от способа сворачивания графитового листа: (а)- кресельская структура,
(б)- зигзагообразная структура, (в)- хиральная структура
Углеродные нанотрубки можно получить лазерным испарением, углеродной дугой и химическим осаждением паров. На рис. 41. показана установка для производства нанотрубок лазерным испарением. Кварцевая трубка, содержащая газообразный аргон и мишень из графита, нагревается до 1200 °С.
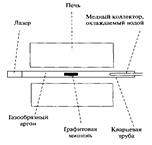
Рис. 41. Экспериментальная установка для синтеза
углеродных нанотрубок лазерным испарением
Внутри трубки, но за пределами печи находится охлаждаемый водой медный коллектор. Графитовая мишень содержит небольшие количества кобальта и никеля, выступающие в качестве каталитических зародышей образования нанотрубок. При попадании высокоинтенсивного пучка импульсного лазера на мишень графит испаряется. Поток аргона выносит атомы углерода из высокотемпературной зоны к охлаждаемому медному коллектору, на котором происходит образование нанотрубок. Таким методом можно получить трубки диаметром 10 - 20 нм и длиной 100 микрон.
Нанотрубки можно синтезировать, используя и углеродную дугу. К электродам из углерода диаметром 5-20 мм, разнесенным на расстояние около 1 мм, в потоке гелия при давлении 500 Торр прикладывается напряжение 20-25 В. Атомы углерода вылетают из положительного электрода и образуют нанотрубки на отрицательном, при этом длина положительного электрода уменьшается, а на отрицательном электроде осаждается углеродный материал. Для получения однослойных нанотрубок в центральную область положительного электрода добавляют небольшие количества кобальта, никеля и железа в качестве катализаторов. Если не использовать катализаторы, получаются вложенные или многослойные нанотрубки, то есть нанотрубка внутри нанотрубки, как показано на рис. 42. Дуговым методом можно получить однослойные нанотрубки диаметром 1-5 нм и длиной порядка 1 мкм.

Рис. 42. Схема вложенных нанотрубок, когда одна трубка находится внутри другой
Методом химического осаждения из паровой фазы заключается в разложении газообразного углеводорода, например, метана (СН4), при температуре 1100 °С. При разложении газа образуются свободные атомы углерода, конденсирующиеся затем на более холодной подложке, которая может содержать разнообразные катализаторы, такие как железо. Этот процесс позволяет получать продукт непрерывно и, возможно, является наиболее предпочтительным для увеличения масштабов при промышленном производстве.
Механизм роста нанотрубок до сих пор неясен. Так как для роста однослойных трубок необходим металлический катализатор, механизм должен объяснять роль атомов кобальта или никеля. Одно из предложений, называемое «механизмом скутера», состоит в том, что атомы металлического катализатора присоединяются к оборванным связям на открытом конце трубки и, обегая ее по краю, способствуют захвату атомов углерода из паровой фазы и их встраиванию в стенку трубки.
Обычно при синтезе получается смесь нанотрубок раз-
ных типов с различным характером и величиной электропроводности. Группа из IBM разработала метод отделения полупроводящих нанотрубок от металлических. Для разделения смешанные пучки нанотрубок осаждают на кремниевую подложку, а затем на эти пучки напыляют металлические электроды. Используя подложку как электрод, на него подают небольшое напряжение смещения, запирающее полупроводниковые трубки и эффективно превращающее их в изоляторы. Затем между металлическими электродами прикладывается высокое напряжение, создающее большой ток в металлических нанотрубках, что приводит к их испарению, после чего на подложке остаются только полупроводниковые нанотрубки.
Молекулярные кристаллы представляют собой молекулы, соединенные силами межмолекулярного взаимодействия, включая и другие дополнительные виды связей. Кристаллы молекулярного типа характерны для органических веществ, а также и других, в молекулы которых входят атомы с близкими значениями электроотрицательностей (так как в противном случае будет проявляться также связь ионного типа).
Ионные кристаллы построены из отдельных разноименно заряженных ионов. Энергия ионных кристаллических решеток должна создаваться за счет электростатических сил взаимодействия, однако, как это было указано ранее, ионной связи в чистом виде не бывает и между ионами в какой-то степени сохраняется также ковалентная связь.
Кроме того, между ионами возникает явление поляризации, что также влияет на энергию ионной кристаллической решетки.
Расчет энергии кристаллических решеток различных соединений дает величины 700 - 1000 кДж/моль, что, вообще говоря, близко совпадает с опытными данными.
Геометрические формы кристаллов простых неорганических соединений (галидов, оксидов) обычно не очень сложны и определяются соотношением радиусов ионов. В присутствии ионов с большим обобщенным потенциалом, вызывающим поляризацию, происходит усложнение кристаллической решетки.
Наиболее простыми кристаллическими решетками ионного типа являются решетки NaCl и CsCl, рассмотренные нами ранее. Однако в кристаллах веществ, содержащих комплексные ионы, структура элементарных ячеек может быть очень сложной. Также очень сложными структурами обладают кристаллы, построенные за счет весьма устойчивого координационного числа 4, характерные для диоксида кремния и его многочисленных соединений.
Дата добавления: 2016-12-09; просмотров: 3191;











