Металлическая связь
Металлические кристаллы отличаются от всех остальных кристаллов высокой пластичностью, электропроводностью и теплопроводностью. Эти свойства, а также и многие другие, обусловлены особым видом связи между атомами металла – металлической связью. Она возникает между атомами металлов в результате их сближения за счет перекрывания внешних орбиталей. Эта связь не является ковалентной неполярной связью, так как электроны не фиксируются между двумя атомами, а переходят в состояние проводимости и могут принадлежать всем атомам данного кристалла и даже куска металла, содержащего громадное количество кристаллических зерен. Эти мигрирующие электроны, или обобщенные электроны, - электроны проводимости (свободные электроны или электронный газ) – и осуществляют ненаправленную связь между остовами атомов в кристаллической решетке металлов.
Металлическая связь представляет собой результат перекрытия делокализованных орбиталей атомов, сближающихся между собой в кристаллической решетке металлических кристаллов.
Особенностью кристаллической структуры металлов являются высокие координационные числа (8-12), свидетельствующие о большой плотности упаковки в кристаллических ячейках. Высокая плотность упаковки объясняется тем, что остовы атомов, лишенные внешних электронных уровней, укладываются в пространстве как шары одинакового радиуса. Типичные для металлов кристаллические решетки показаны на рис. 43.
ОЦК - Объемноцентрированная кубическая решетка (К 8) (рис. 43, а) характеризуется следующими данными: а) координационное число К = 8; б) кратчайшее расстояние между центрами атомов равно половине диагонали куба 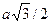 ; в) число атомов, необходимое для построения, п = 2, так как 8 вершин содержат 1/8 атома, приходящегося на данный куб, и в центре куба находится еще один атом;
; в) число атомов, необходимое для построения, п = 2, так как 8 вершин содержат 1/8 атома, приходящегося на данный куб, и в центре куба находится еще один атом;
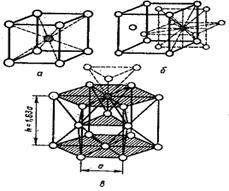
Рис. 43. Металлические решетки
г) плотность упаковки или часть пространства, занятая атомами в данном кубе, составляет ~68 %. В таких решетках кристаллизуются К, Na, W, α- Fe, β- Ti и др.
ГЦК - Гранецентрированная кубическая решетка (К 12) (рис. 43, б)определяется следующими данными: а) координационное число К = 12; б) кратчайшее расстояние между центрами атомов равно половине диагонали грани 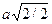 ; в) число атомов, необходимое для построения, равно 4, так как на все вершины нужен только один атом, а атом, находящийся в центре грани, наполовину принадлежит данному кубу, а таких граней 6. Следовательно, n = 8(1/8) + 6(1/2) = 4; г) плотность упаковки в данной решетке составляет ~74 %. В таких решетках кристаллизуются Сu; Ni; γ- Fe; Pb и др.
; в) число атомов, необходимое для построения, равно 4, так как на все вершины нужен только один атом, а атом, находящийся в центре грани, наполовину принадлежит данному кубу, а таких граней 6. Следовательно, n = 8(1/8) + 6(1/2) = 4; г) плотность упаковки в данной решетке составляет ~74 %. В таких решетках кристаллизуются Сu; Ni; γ- Fe; Pb и др.
ГПУ - Гексагональная решетка плотной упаковки (Г 12) (рис. 43, в) более сложная, но по степени упаковки совпадает с гранецентрированной кубической. Ее данные: а) координационное число К = 12;б) кратчайшее расстояние между центрами атомов а равно стороне правильного шестиугольника основания призмы. Все атомы, если их представить шарами радиусом а/2, будут в этой решетке касаться друг друга. Поэтому высота призмы h в идеальном случае (Mg, Be) должна быть рав
на 1,63 а или двум высотам тетраэдров, построенных из этих шаров; в) число атомов, необходимых для построения, равно 6. На каждой вершине призмы расположен атом, одновременно принадлежащий шести сходящимся в одной точке решеткам. Вершин 12 x 1/6 = 2. В центре верхнего и нижнего основания лежат атомы, половина которых относится к данной решетке: 2 x 1/2 = l. Внутри призмы находятся еще три атома и всего получается n = 12 х 1/6 + 2 х 1/2 +3 = 6; г) плотность упаковки 74 %. В таких решетках кристаллизуется Be, Mg, Zn, α- Tiи др.
Дата добавления: 2016-12-09; просмотров: 1867;











