Межмолекулярное взаимодействие
Известны следующие агрегатные состояния веществ: газообразное, жидкое и твердое. Жидкое и твердое состояния называют также конденсированным состоянием. Любое вещество при определенных условиях может быть получено в кристаллическом состоянии.
Каждое из этих состояний определяется соотношением между силами отталкивания и притяжения молекул. Силы притяжения или сцепления между молекулами были установлены Ван-дер-Ваальсом (1873 г.) и были названы вандерваальсовыми.
Ван-дер-ваальсовы силы зависят прежде всего от расстояния между центрами взаимодействующих молекул. На больших расстояниях эти силы ничтожно малы (при нормальных давлениях). В газах, находящихся под высоким давлением, силы межмолекулярного взаимодействия следует учитывать. Энергия межмолекулярного взаимодействия невелика и составляет около 8-47 кДж/моль, т.е. в 10-100 раз меньше энергии химического взаимодействия между молекулами.
Поскольку в жидкости расстояния между молекулами меньше, чем в газе, в ней Ван-дер-ваальсовы силы проявляются в большей степени (сфера действия этих сил – 10 А0). Жидкость частично может обладать упорядоченной структурой (ближний порядок), т.е. часть молекул в ней сохраняет определенное пространственное расположение, объединившись в некоторый микрокристаллит, при более низкой температуре их образуется больше.
В твердых телах поступательное движение молекул отсутствует: частицы могут совершать лишь колебательные движения около определенных центров равновесия. Силы межмолекулярного взаимодействия в данном агрегатном состоянии имеют наибольшее значение, а расстояние между молекулами достигает некоторого минимума.
Природа Ван-дер-ваальсовых сил.Различают три типа электростатического взаимодействия: ориентационное, индукционное и дисперсионное.
1) Ориентационное им диполь - дипольное взаимодействие проявляется между полярными молекулами. При сближении таких молекул они ориентируются. Одноименно заряженные концы диполей взаимноотталкиваются, а противоположные – притягиваются. Чем более полярны молекулы, тем упорядоченнее ориентация. Повышение температуры уменьшает ориентационное взаимодействие молекул.
2) Индукционное взаимодействие происходит между полярной и неполярной молекулами.
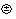
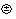
µ ≠ 0 µ = 0
Электрическое поле полярной молекулы может индуцировать диполь (μi ≠ 0), следовательно, молекула становится индуцировано-полярной. Возникает индуцированное взаимодействие. Индуцирование приводит к деформации электронной оболочки молекулы, поэтому этот тип взаимодействия называют иногда деформационным. Эффект индуцирования не зависит от температуры раствора, а зависит от напряженности электрического поля молекулы.
Третий тип взаимодействия (взаимодействие между неполярными молекулами) называется дисперсионным. Хотя у обоих неполярных молекул дипольный момент равен нулю, вследствие пульсирующего движения электронного облака (или движения электронов внутри молекулы) в одной из молекул на мгновение возникает незначительный дипольный момент, который индуцирующе действует на соседнюю молекулу. Между этими молекулами возникает дисперсионное взаимодействие. Для реальных молекул при их взаимодействии проявляются все три типа взаимодействия: ориентационное, индуцированное и дисперсионное. Общая энергия притяжения между молекулами Eобщ., является суммой энергий ориентационного (Eо), индуцированного (Eи) и дисперсионного (Eд) взаимодействия
Eобщ. = Eо + Eи + Eд
Таким образом, Ван-дер-ваальсовы силы обусловлены электрическими полями молекул или атомов.
Дата добавления: 2016-12-09; просмотров: 2095;











