К осевым лопаточным машинам
В термодинамике доказывается [20], что при переходе термодинамической системы из состояния i в состояние i + 1 изменение её полной энергии будет определяться выражением
DE(i¸i+1) = ±DQвн ±DLтехн, (1.11)
где DQвн - количество тепла, подведенного (или отведенного) к системе; DLтехн - работа, выполненная системой во время цикла.
Применительно к осевым лопаточным машинам величину DE удобно подразделять на три составляющие:
изменение внутренней энергии – cVDT, где DT - температурный интервал в процессе сжатия или расширения;
изменение потенциальной энергии сил давления - Dp/r;
изменение кинетической энергии - Dc2/2.
Для случая осевых ЛМ, когда К и Т выполняются неохлаждаемыми, выражение (1.11) принимает вид:
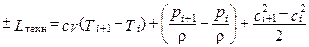 .
.
В термодинамике сумму внутренней и потенциальной энергий сил давления называют энтальпией, т.е. cVTi + pi /ri = ii. Тогда
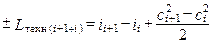 . (1.12)
. (1.12)
Очень часто, полагая ii + ci2/2 = ii*, выражение (1.12) записывают в виде
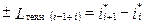 . (1.13)
. (1.13)
Выражения (1.12) и (1.13) применительно к осевым ЛМ носят название уравнения энергии в тепловой форме.
Нетрудно видеть, что уравнение энергии в форме (1.12) и (1.13) универсально: оно пригодно для описания как одномерных, так и двухмерных моделей рабочего процесса ЛМ. При этом под величинами pi, Ti, ci, ri понимаются их некоторые средние значения, соответствующие рассматриваемой модели ЛМ.
Рассмотрим более подробно уравнение энергии применительно к К. Пусть в К к рабочему телу с расходом Gв подводится мощность Nк. Если поделить Nк на Gв, то получим удельную работу, сообщаемую в К 1 кг газа. В книгах эта величина обозначается Hк и носит название:
работа сжатия в К;
полная работа сжатия в К;
работа, затрачиваемая на сжатие;
внутренняя работа сжатия.
Определим размерность Hк:
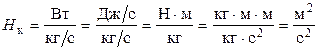 .
.
Следовательно, величина Hк имеет размерность квадрата скорости.
Для одномерной модели ОК (1.12) примет вид:
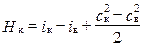 ,
,
т.е. удельная работа, подводимая в К, тратится на изменение теплосодержания и кинетической энергии.
В полных параметрах выражение (1.13) для К примет следующий вид:
Hк = iк* - iв*.
Если учесть, что i* = cpT*, то из последнего выражения следует: при Hк >> 0
Tк* >> Tв*.
Запишем выражение (1.12) применительно к двухмерной модели ОК (см. рис. 1.11):
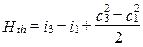 ,
,
откуда следует, что удельная теоретическая работа Hth, сообщаемая 1 кг газа в ступени, расходуется на изменение теплосодержания и кинетической энергии. В полных параметрах выражение (1.13) можно записать:
Hth = i3* - i1*,
здесь при Hth>> 0 - T3*>>T1*, т.е. температура торможения в ступени возрастает.
В силу универсальности уравнения (1.12) и (1.13) могут быть применены также и к отдельно взятым лопаточным венцам, при этом процесс можно рассматривать как в абсолютном, так и в относительном движении.
Рассмотрим, например, уравнение (1.13) применительно к решётке РК в относительном движении (см. рис. 1.11):
HРК (w) = i*w2 - i*w1.
Так как HРК (w) = 0, то i*w1 = i*w2 и, следовательно, T*w1 = T*w2, т.е. температура поверхности лопаток РК вдоль оси не изменяется.
Применительно к одномерной модели ОТ выражение (1.12) можно записать:
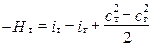 ,
,
здесь Hт взята со знаком (-), так как с точки зрения термодинамики [20] от газа отводится работа. В расчётной практике выгоднее иметь дело с положительными величинами, поэтому последнее выражение перепишем:
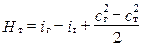 ,
,
откуда следует, что работа, совершаемая 1 кг газа в Т, осуществляется за счёт изменения теплосодержания и кинетической энергии. Используя выражение (1.13), получаем
Hт = iг* - iт*,
откуда следует, что при совершении газом работы температура его в Т уменьшается, т.е. Tт* << Tг*.
Аналогичные результаты можно получить, применив (1.12) и (1.13) к элементам ступени Т. Например, для СА можно записать (см. рис. 1.12):
HСА = i0* - i1*,
откуда следует, что T0* = T1*, так как HСА = 0.
Итак, уравнение энергии в тепловой форме позволяет связать величины Hi, Ti, Ti* и ci (или wi). Однако, как в К, так и в Т происходит ещё и изменение p, поэтому возникает необходимость в такой записи уравнения энергии, где фигурировало бы давление p.
Дата добавления: 2021-03-18; просмотров: 512;











