Третий закон термодинамики
Понятие химического сродства.Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует какое-то химическое сродство.
1-е предположение – мерой химического сродства была скорость реакции.
2-е предположение – М. Бертло и Х. Томсон высказали, что мерой химического сродства является тепловой эффект.
3-е предположение – max А (Вант-Гофф). Если max А > 0, то химическое сродство между веществами существует, и реакция протекает слева направо. Если Аmax< 0 >, то химического сродства между веществами нет, и реакция протекает справа налево. ЕслиАmax= 0, то реакция протекает и туда, и обратно. На основе этого создавался третий закон термодинамики; М. Бертло и Х. Томсон, изучая поведение термодинамических систем при низких температурах, в 1906 г. обнаружили, что при низких температурах между веществами существует так называемое химическое сродство, которое они определили как тепловой эффект, ими было установ-лено, что тепловой эффект Qv – Аmaxв конденсированных системах при низких температурах, где Аmax – максимальная работа.
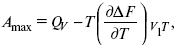
но на самом деле это не max, если исходить из уравнения Гельмгольца.
Для того, чтобы работа была max, она должна равняться тепловому эффекту Amax = Qv,надо вычислить:
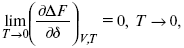
?F = Qv.
Аналитические выражения третьего закона термодинамики:
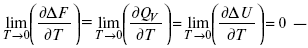
это изохорно-изотермические условия.
Если Аmax = QP, ?G, Qp, ?H – функции
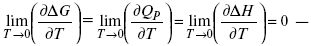
это изобарно-изотермические условия.
Тепловая теорема Нернста(третий закон термодинамики)(рис. 16)
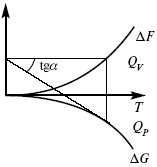
Рис. 16
Энергии (?U, ?H, QV, QP, ?F, ?G), tg?угла наклона прямой – дает температурный коэффициент любой функции.
Для реакций, протекающих в конденсированных системахпри приближении температуры к абсолютному нулю, кривые max работы и теплового эффекта соединяются и имеют одну большую касательную, параллельную оси температур.
Следствия из третьего закона термодинамики:
1. Свойства энтропии вблизи абсолютного нуля – постулат Планка:
?F = ?U – T?S.
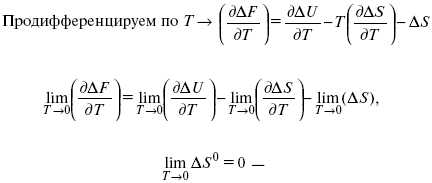
абсолютная энтропия.
2. Теплоемкость Сp, Сv
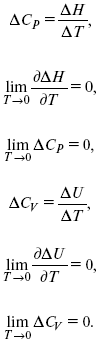
3. Коэффициент термического расширения тела и термического давления.
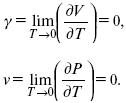
Идеальные газы не подчиняются третьему закону термодинамики, так как газ вблизи абсолютного нуля называется вырожденным.
CP – CV ? R вблизи абсолютного нуля – уравнение Майера не работает.
4. О невозможности достижения абсолютного нуля. Третий закон термодинамики – приближенный закон. Используется для совершенного кристалла любого вещества.
Понятие термохимии
Раздел физической химии и химической термодинамики, изучающий тепловые процессы теплоемкости веществ, называется термохимией.
?Q = dU + ?A– первый закон термодинамики. ?Q – не является функцией состояния. P = const || V = const – функции состояния при этих условиях. ?QP = dH || ?QV= dUвн– функции состояния при этих условиях.
Закон Гесса
При изобарных и изохорных условиях теплота является функцией состояния.
В 1840 г. Г. Н. Гесс формулирует закон: «Тепловой эффект химической реакции не зависит от промежуточных стадий, а зависит только от начального и конечного состояния системы».
?QP = dH,
?QV = dUвн,
QP = ?H,
QV = ?Uвн.
Современная формулировка закона Гесса– общие приращения энтальпии при переходе начальных веществ в продукты реакции не зависят от того, через какие промежуточные стадии прошла реакция.
Закон Гесса позволяет рассчитать тепловые эффекты или приращение энтальпии только при стандартных условиях (р = 1 атм = 105 Па, Т = 273 К + 25 = 298 К).
Теплоты при стандартных условиях сведены в таблицу (справочник под редакцией Нищенко). Для индивидуальных веществ: С, Н2, Fe и др. – ?Н = 0.
Следствия из закона Гесса:
1) энтальпия образования 1 моля соединения из простых веществ не зависит от способа получения;
2) теплоты сгорания – «теплота реакции равна сумме теплот сгорания исходящих веществ за вычетом теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов»
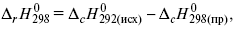
где r – реакции;
c – композиция;
3) теплоты образования – «тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения (продукт реакции), и теплотами образования всех веществ, указанных в левой части уравнения».
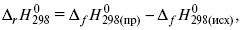
где f – формация.
Пример 1.Рассчитать тепловой эффект реакции этерификации спирта.
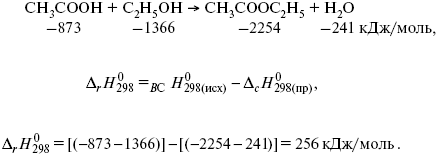
Пример 2.Рассчитать тепловой эффект реакции, протекающей по уравнению:
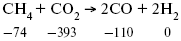
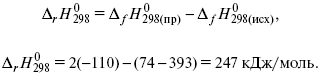
Дата добавления: 2016-11-26; просмотров: 2826;











