Константа химического равновесия
При равновесии химической реакции:
bB + dD = lL + mM
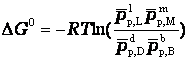
или
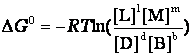 ,
,
где pp,L, ppM, pp,D, ppB –равновесные парциальные давления веществ, а [L], [M],[D],[B] –равновесные концентрации веществ; l, m, d, b - показатели степени, равные стехиометрическим коэффициентам.
Отношения произведений парциальных давлений или концентраций получили названия констант химического равновесия соответственно Кр или Кс:
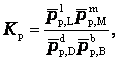
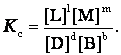
Эти уравнения являются математическими выражениями закона действующих масс, открытого норвежскими учеными К. Гульдбергом и П. Вааге в 1867 г.:
отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, при Т = соnst, является величиной постоянной.
Например, для реакции синтеза аммиака:
N2 + 3H2 = 2NH3
закон действующих масс имеет вид:
Кс = [NH3]2 /[N2][H2]3
Подставляя выражение константы в уравнения, получаем
ΔG0 = - RTlnKc = - 2,3RTlgKp,
ΔG0 = - RTlnKp = - 2,3RTlgKc.
Рассчитав величину ΔG0 химической реакции, можно определить константу химического равновесия. Используя закон действующих масс, можно рассчитать равновесные концентрации реагирующих веществ.
Дата добавления: 2016-11-26; просмотров: 2269;











