Смеси идеальных газов
Все зависимости, полученные выше для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теплоемкость смеси.
Закон Дальтона.В инженерной практике часто приходится иметь дело с газообразными веществами, близкими по свойствам к идеальным газам и представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. Это так называемые газовые смеси. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания, топках печей и паровых котлов, влажный воздух в сушильных установках и т. п.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:
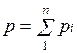
Парциальное давление pi — давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси.
Способы задания смеси.Состав газовой смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Мi, к массе смеси М:
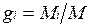 .
.
Очевидно, что 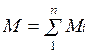
 и
и 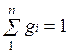 .
.
Массовые доли часто задаются в процентах. Например, для сухого воздуха 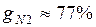 ;
; 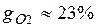 .
.
Объемная доля представляет собой отношение приведенного объема газа V, к полному объему смеси V: 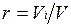 .
.
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния i-го компонента:
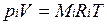 ; (2.1)
; (2.1)
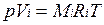 .
.
Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
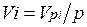 . (2.2)
. (2.2)
Просуммировав соотношение (2.2) для всех компонентов смеси, получим с учетом закона Дальтона 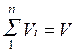 ,откуда
,откуда 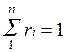 . Объемные доли также часто задаются в процентах. Для воздуха
. Объемные доли также часто задаются в процентах. Для воздуха 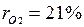 ,
, 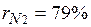 .
.
Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
Пусть газовая смесь состоит из N1 молей первого компонента, N2 молей второго компонента и т. д. Число молей смеси 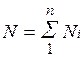 , а мольная доля компонента будет равна
, а мольная доля компонента будет равна 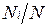 .
.
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля 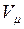 на число молей этого компонента, т. е.
на число молей этого компонента, т. е. 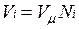 а объем смеси — по формуле
а объем смеси — по формуле 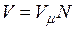 . Тогда
. Тогда 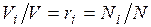 , и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.
, и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.
Газовая постоянная смеси газов. Просуммировавуравнения (2.1) для всех компонентов смеси, получим 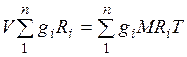 . Учитывая
. Учитывая 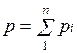 , можно записать
, можно записать
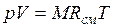 , (2.3)
, (2.3)
где
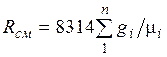 . (2.4)
. (2.4)
Из уравнения (2.3) следует, что смесь идеальных газов также подчиняется уравнению Клапейрона. Поскольку 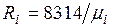 то из (2.4) следует, что газовая постоянная смеси [Дж/(кг-К)] имеет вид
то из (2.4) следует, что газовая постоянная смеси [Дж/(кг-К)] имеет вид
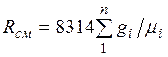 (2.5)
(2.5)
Кажущаяся молекулярная масса смеси. Выразим формально газовую постоянную смеси R, введя кажущуюся окулярную массу смеси 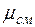 :
: 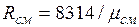 (2.6)
(2.6)
Сравнивая правые части соотношений (2.5) и (2.6), найдем
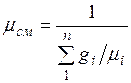 .
.
Изопределения массовых долей следует, что
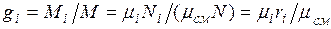
Просуммировав это соотношение для всех компонентов и учитывая, что 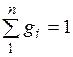 , получим выражение для кажущейся молекулярной и массы смеси, заданной объемными долями:
, получим выражение для кажущейся молекулярной и массы смеси, заданной объемными долями:
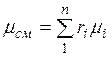 . (2.7)
. (2.7)
Соотношение между объемными и массовыми долями. Учитывая (2.7), получаем 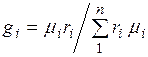 .
.
Поскольку 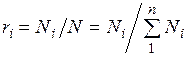 , то
, то
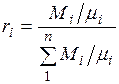
Разделив числитель и знаменатель этой формулы на массу смеси М, получим
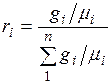 .
.
Аналитическое выражение первого закона термодинамики
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям. В соответствии с уравнением Эйнштейна 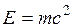 надо рассматривать единый закон сохранения и превращения массы и энергии. Однако в технической термодинамике мы имеем дело со столь малыми скоростями объекта, что дефект массы равен нулю, и поэтому закон сохранения энергии можно рассматривать независимо.
надо рассматривать единый закон сохранения и превращения массы и энергии. Однако в технической термодинамике мы имеем дело со столь малыми скоростями объекта, что дефект массы равен нулю, и поэтому закон сохранения энергии можно рассматривать независимо.
Закон сохранения и превращения энергии является фундаментальным законом природы, который получен на основе обобщения огромного количества экспериментальных данных и применим ко всем явлениям природы. Он утверждает, что энергия не исчезает и не возникает вновь, она лишь переходит из одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество энергии другого вида.
В числе первых ученых, утверждавших принцип сохранения материи и энергии, был наш соотечественник М. В. Ломоносов (1711 — 1765 гг.).
Пусть некоторому рабочему телу с объемом V и массой М, имеющему температуру Т и давление р, сообщается извне бесконечно малое количество теплоты 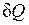 . В результате подвода теплоты тело нагревается на dT и увеличивается в объеме на dV.
. В результате подвода теплоты тело нагревается на dT и увеличивается в объеме на dV.
Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на dU. Поскольку рабочее тело окружено средой, которая оказывает на него давление, то при расширении оно производит механическую работу 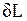 против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
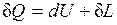 (2.8)
(2.8)
т. е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
Полученное уравнение является математическим выражением первого закона термодинамики. Каждый из трех членов этого соотношения может быть положительным, отрицательным или равным нулю. Рассмотрим некоторые частные случаи.
1. 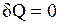 — теплообмен системы с окружающей средой отсутствует, т. е. теплота к системе не подводится и от нее не отводится. Процесс без теплообмена называется адиабатным. Для него уравнение (2.8) принимает вид:
— теплообмен системы с окружающей средой отсутствует, т. е. теплота к системе не подводится и от нее не отводится. Процесс без теплообмена называется адиабатным. Для него уравнение (2.8) принимает вид:
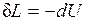 .
.
Следовательно, работа расширения, совершаемая системой в адиабатном процессе, равна уменьшению внутренней энергии данной системы. При адиабатном сжатии рабочего тела затрачиваемая извне работа целиком идет на увеличение внутренней энергии системы.
2. 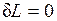 — при этом объем тела не изменяется, dV=0 . Такой процесс называется изохорным, для него
— при этом объем тела не изменяется, dV=0 . Такой процесс называется изохорным, для него
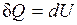 ,
,
т. е. количество теплоты, подведенное к системе при постоянном объеме, равно увеличению внутренней энергии данной системы.
3. dU=0 – внутренняя энергия системы не изменяется и
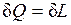 ,
,
т.е. сообщаемая системе теплота превращается в эквивалентную ей внешнюю работу.
Для системы, содержащей 1 кг рабочего тела
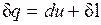 . (2.9)
. (2.9)
Проинтегрировав уравнения (2.8) и (2.9) для некоторого процесса, получим выражение первого закона термодинамики в интегральной форме:
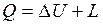 ;
; 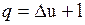 .
.
ЛЕКЦИЯ 3
Внутренняя энергия
Внутренняя энергия системы включает в себя:
кинетическую энергию поступательного, вращательного и колебательного движения частиц;
потенциальную энергию взаимодействия частиц;
энергию электронных оболочек атомов;
внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией будем понимать энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами.
Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т. е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела.
Для сложной системы она определяется суммой энергий отдельных частей, т. е. обладает свойством аддитивности. Величина и=U/М, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества.
В дальнейшем для краткости будем называть величину и просто внутренней энергией. Поскольку внутренняя энергия есть функция состояния тела, то она может быть представлена в виде функции двух любых независимых параметров, определяющих это состояние:
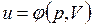 ;
; 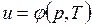 ;
; 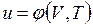 .
.
Ее изменение в термодинамическом процессе 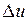 не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
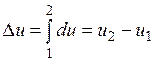 ;
;
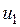 — значение внутренней энергии в начальном состоянии, а
— значение внутренней энергии в начальном состоянии, а 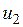 — в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то
— в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то
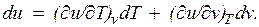
Внутренняя энергия идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления 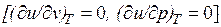 , а определяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:
, а определяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:
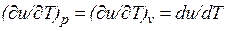
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно. Например, в соответствии с международным соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление 610,8 Па, а для идеальных газов — при 0 °С вне зависимости от давления.
Работа расширения
Работа в термодинамике, так же как и в механике, определяется произведением действующей на рабочее тело силы на путь ее действия.
Рассмотрим газ массой М и объемом V, заключенный в эластичную оболочку с поверхностью F.
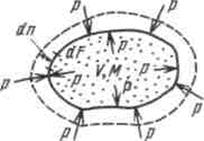 |
Если газу сообщить некоторое количество теплоты, то он будет расширяться, совершая при этом работу против внешнего давления р, оказываемого на него средой. Газ действует на каждый элемент оболочки dF с силой, равной pdF и, перемещая ее по нормали к поверхности на расстояние dn, совершает элементарную работу pdFdn. Общую работу, совершенную в течение бесконечно малого процесса, получим, интегрируя данное выражение по всей поверхности F оболочки: 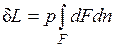 .
.
Из рисунка видно, что изменение объема dV выражается в виде интеграла по поверхности: 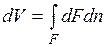 , следовательно
, следовательно
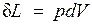 . (3.1)
. (3.1)
При конечном изменении объема работа против сил внешнего давления, называемая работой расширения, равна
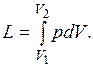
Из (3.1) следует, что 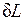 и dV всегда имеют одинаковые знаки:
и dV всегда имеют одинаковые знаки:
если dV>0, то и 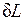 >0, т. е. при расширении работа тела положительна, при этом тело само совершает работу;
>0, т. е. при расширении работа тела положительна, при этом тело само совершает работу;
если же dV<0, то и 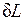 <0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне. Единицей измерения работы в СИ является джоуль (Дж).
<0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне. Единицей измерения работы в СИ является джоуль (Дж).
Отнеся работу расширения к 1 кг массы рабочего тела, получим
l = L/M; 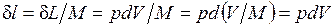 .
.
Величина , представляющая собой удельную работу, совершаемую системой, содержащей 1 кг газа, равна
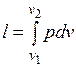 . (3.2)
. (3.2)
Поскольку в общем случае р — величина переменная, то интегрирование возможно лишь тогда, когда известен закон изменения давления р = р(v).
Формулы (3.1) — (3.2) справедливы только для равновесных процессов, при которых давление рабочего тела равно давлению окружающей среды.
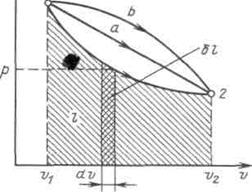
В термодинамике для исследования равновесных процессов широко используют р,v – диаграмму, в которой осью абсцисс служит удельный объем, а осью ординат — давление. Поскольку состояние термодинамической системы определяется двумя параметрами, то на р,v – диаграмме оно изображается точкой. На рисунке точка 1 соответствует начальному состоянию системы, точка 2 — конечному, а линия 12 — процессу расширения рабочего тела от v1 до v2. При бесконечно малом изменении объема площадь заштрихованной вертикальной полоски равна 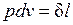 ; следовательно, работа процесса 12 изображается площадью, ограниченной кривой процесса, осью абсцисс и крайними ординатами.
; следовательно, работа процесса 12 изображается площадью, ограниченной кривой процесса, осью абсцисс и крайними ординатами.
Таким образом, работа изменения объема эквивалентна площади под кривой процесса в диаграмме р, v (рисунок 3.1).
|
Рисунок 3.1 - Графическое изображение работы в р, v – координатах
Каждому пути перехода системы из состояния / в состояние 2 (например, 12, 1а2 или 1b2) соответствует своя работа расширения.Следовательно, работа зависит от характера термодинамического процесса, а не является функцией только исходного и конечного состояний системы. С другой стороны, 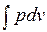 зависит от пути интегрирования и, следовательно, элементарная работа
зависит от пути интегрирования и, следовательно, элементарная работа 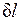 не является полным дифференциалом.
не является полным дифференциалом.
Работа всегда связана с перемещением макроскопических тел в пространстве, например перемещением поршня, деформацией оболочки, поэтому она характеризует упорядоченную (макрофизическую) форму передачи энергии от одного тела к другому и является мерой переданной энергии. Поскольку величина 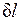 пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для преобразования тепловой энергии в механическую, целесообразно выбирать такие, которые обладают способностью значительно увеличивать свой объем. Этим качеством обладают газы и пары жидкостей. Поэтому, например, на тепловых электрических станциях рабочим телом служат пары воды, а в двигателях внутреннего сгорания — газообразные продукты сгорания того или иного топлива.
пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для преобразования тепловой энергии в механическую, целесообразно выбирать такие, которые обладают способностью значительно увеличивать свой объем. Этим качеством обладают газы и пары жидкостей. Поэтому, например, на тепловых электрических станциях рабочим телом служат пары воды, а в двигателях внутреннего сгорания — газообразные продукты сгорания того или иного топлива.
Теплота
Помимо макрофизической формы передачи энергии — работы существует также и микрофизическая, т. е. осуществляемая на молекулярном уровне форма обмена энергией между системой и окружающей средой. В этом случае энергия может быть передана системе без совершения работы. Мерой количества энергии, переданной микрофизическим путем, служит теплота.
Теплота может передаваться либо при непосредственном контакте между телами (теплопроводностью, конвекцией), либо на расстоянии (излучением), причем во всех случаях этот процесс возможен только при наличии разности температур между телами.
Как будет показано ниже, элементарное количество теплоты 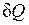 , так же как и L, не является полным дифференциалом в отличие от дифференциала внутренней энергии dU. За этой математической символикой скрыт глубокий физический смысл различия понятий внутренней энергии, теплоты и работы.
, так же как и L, не является полным дифференциалом в отличие от дифференциала внутренней энергии dU. За этой математической символикой скрыт глубокий физический смысл различия понятий внутренней энергии, теплоты и работы.
Внутренняя энергия — это свойство самой системы, она характеризует состояние системы. Теплота и работа — это энергетические характеристики процессов механического и теплового взаимодействий системы с окружающей средой. Они характеризуют те количества энергии, которые переданы системе или отданы ею через ее границы в определенном процессе.
Энтальпия
В термодинамике важную роль играет сумма внутренней энергии системы U и произведения давления системы р на ее объем V, называемая энтальпией и обозначаемая Н:
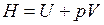 .
.
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности. Величина
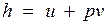 ,
,
называемая удельной энтальпией (h = H/M), представляет собой энтальпию системы, содержащей 1 кг вещества, и измеряется в Дж/кг.
Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния:
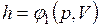 ;
; 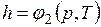 ;
; 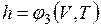 ,
,
а величина dh является полным дифференциалом.
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Физический смысл энтальпии выясним на следующем примере. Рассмотрим расширенную систему, включающую газ в цилиндре и поршень с грузом общим весом G .
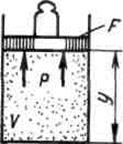 |
Энергия этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом в поле внешних сил: 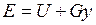 . В условиях равновесия (G = pF) эту функцию можно выразить через параметры газа:
. В условиях равновесия (G = pF) эту функцию можно выразить через параметры газа: 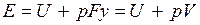 . Получаем, что
. Получаем, что 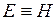 , т.е. энтальпию можно трактовать как энергию расширенной системы.
, т.е. энтальпию можно трактовать как энергию расширенной системы.
Уравнение 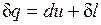 в случае, когда единственным видом работы является работа расширения, с учетом очевидного соотношения
в случае, когда единственным видом работы является работа расширения, с учетом очевидного соотношения 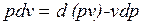 может быть записано в виде
может быть записано в виде 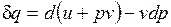 , или
, или
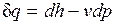 .
.
Из этого соотношения следует, что если давление системы сохраняется неизменным, т. е. осуществляется изобарный процесс (dp=0), то
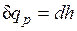 и
и 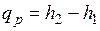 .
.
т. е. теплота, подведенная к системе при постоянном давлении, идет только на изменение энтальпии данной системы.
Это выражение очень часто используется в расчетах, так как огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах, камерах сгорания газовых турбин и реактивных двигателей, теплообменных аппаратах), а также целый ряд процессов химической технологии и многих других осуществляется при постоянном давлении. Кстати, по этой причине в таблицах термодинамических свойств обычно приводятся значения энтальпии, а не внутренней энергии.
Для идеального газа с учетом получим
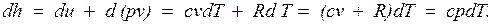
Так как между энтальпией и внутренней энергией существует связь 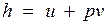 , выбор начала отсчета одной из них не произволен: в точке, принятой за начало отсчета внутренней энергии, h = pv.
, выбор начала отсчета одной из них не произволен: в точке, принятой за начало отсчета внутренней энергии, h = pv.
Например, для воды при t=0.01ºC и р =610,8 Па, u = 0, a
h = pv = 0,611 Дж/кг.
При расчетах практический интерес представляет изменение энтальпии в конечном процессе: 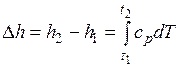 .
.
Энтропия
Как уже указывалось, величина 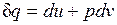 не является полным дифференциалом. Действительно, для того чтобы проинтегрировать правую часть этого выражения, нужно знать зависимость р от v, т. е. процесс, который совершает газ.
не является полным дифференциалом. Действительно, для того чтобы проинтегрировать правую часть этого выражения, нужно знать зависимость р от v, т. е. процесс, который совершает газ.
В математике доказывается, что дифференциальный двучлен всегда можно превратить в полный дифференциал путем умножения (или деления) на интегрирующий множитель (или делитель). Таким интегрирующим делителем для элементарного количества теплоты q является абсолютная температура Т.
Покажем это на примере изменения параметров идеального газа в равновесных процессах:
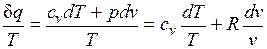 . (3.3)
. (3.3)
Выражение 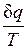 при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропией, обозначается для 1 кг газа через s и измеряется в Дж/(кгК). Для произвольного количества газа энтропия, обозначаемая через S, равна S=Ms и измеряется в Дж/К.
при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропией, обозначается для 1 кг газа через s и измеряется в Дж/(кгК). Для произвольного количества газа энтропия, обозначаемая через S, равна S=Ms и измеряется в Дж/К.
Таким образом, аналитически энтропия определяется следующим образом:
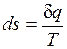 . (3.4)
. (3.4)
Формула (3.4) справедлива как для идеальных газов, так и для реальных тел. Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
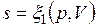 ;
; 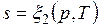 ;
; 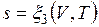 .
.
Значение энтропии для заданного состояния определяется интегрированием уравнения (3.4):
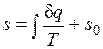
где 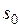 — константа интегрирования.
— константа интегрирования.
При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. В. Нернст (1906 г.) экспериментально установил, а М. Планк (1912 г.) окончательно сформулировал следующий принцип: при температуре , стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю, т. е. s0 = 0 при Т = 0 К. Этот закон называют третьим законом термодинамики или тепловой теоремой Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
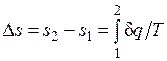 ,
,
поэтому энтропию тоже часто отсчитывают от произвольно выбранного уровня.
Получим формулы, позволяющие вычислить изменение энтропии идеального газа. Для этого проинтегрируем уравнение (3.3), положив для простоты cv= const:
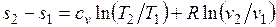 . (3.5)
. (3.5)
Из уравнения Клапейрона, записанного для состояний 1 и 2, следует:
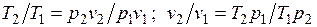 .
.
После подстановки отношений и в выражение (3.4) получим следующие формулы для изменения энтропии идеального газа:
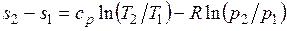 ;
;
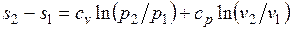 . (3.6)
. (3.6)
Поскольку энтропия есть функция состояния рабочего тела, уравнениями (3.5) — (3.6) можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями 1 и 2 и, в частности, от того, равновесный этот переход или нет.
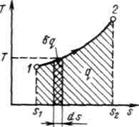
Рисунок 3.2 - Графическое изображение теплоты в T, s – координатах
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов Т, s-диаграмму, на которой (как и на p,v -диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией (Рисунок 3.2).
В равновесном процессе
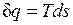 ;
;
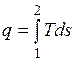 .
.
Очевидно, что в Т, s-диаграмме элементарная теплота процесса 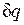 изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Формула 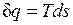 показывает, что ds и
показывает, что ds и 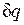 имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу (
имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу ( 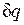 >0) его энтропия возрастает (ds>0), а при отводе теплоты (
>0) его энтропия возрастает (ds>0), а при отводе теплоты ( 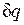 <0) — убывает (ds<0).
<0) — убывает (ds<0).
ЛЕКЦИЯ 4
Дата добавления: 2016-11-04; просмотров: 5204;











